
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

【答案】 升高温度、搅拌、提高硫酸浓度等 MgCO3+2H+=Mg2++H2O+CO2↑ MgSiO3+2H+=Mg2++H2SiO3 将Fe2+氧化为Fe3+ ,便于除去 KSCN 溶液 MgO、Mg(OH)2、MgCO3或Mg2(OH)2 CO3 5.0<pH<8.5 293K~313K(313K以下也可) 5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O
【解析】试题分析:本题通过“用工业废料制备MgCO3·3H2O”的研究,主要考查外界条件对化学反应速率的影响、离子反应方程式、化学方程式、Fe2+的还原性、Fe3+检验、溶度积的计算等基础知识,考查考生对流程图的分析能力、溶度积的认识和理解、X射线衍射谱图的分析能力和化学知识的综合运用能力。
解析:(1)废渣中的MgCO3、MgSiO3、Fe、Al分别与H2SO4反应生成MgSO4、FeSO4、Al2(SO4)3、H2SiO3等,根据影响化学反应速率的因素相关知识,为了提高酸溶速率,可以采取粉碎固体、适当升高溶液温度、适当提高硫酸浓度、搅拌等措施。正确答案:粉碎固体(或者适当升高溶液温度、适当提高硫酸浓度等)、MgCO3+2H+=Mg2++H2O+CO2↑及MgSiO3+2H+=Mg2++H2SiO3。(2)酸溶后过滤除去H2SiO3,溶液中加入30%的H2O2可以将Fe2+氧化成Fe3+,这样便可以在下一步用有机溶剂通过萃取除去Fe3+。正确答案:将Fe2+氧化为Fe3+ ,便于萃取除去。(3)萃取完成后,检验Fe3+可以取萃取后的水溶液,加入KSCN溶液,混合溶液不变成红色说明不含Fe3+。正确答案:KSCN溶液。(4)萃取分液后还需要除去Al3+,可以加入MgO(或者Mg(OH)2、或MgCO3)消耗H+使溶液酸性减弱进而生成Al(OH)3沉淀。根据Al(OH)3的溶度积常数, ![]() ,则c(OH-)=1×10-9mol/L,c(H+)=1×10-5mol/L,pH=5。既当溶液pH=5时,Al(OH)3开始沉淀,而pH=8.5时,Mg(OH)2开始沉淀,因此为了除去Al3+并确保Mg2+不损失,需控制溶液pH为5~8.5。正确答案:MgO(或Mg(OH)2、或MgCO3、或Mg2(OH)2 CO3)、5.0~8.5(或5.0<pH<8.5)。(5)从图中可以得知,当温度升高至313K以上, MgCO3·3H2O就有可能发生反应,323K既更高温度下,MgCO3·3H2O转变成Mg5 (OH)2 (CO3)4· 4H2O,影响产品质量。所以温度应当控制在313K以下。323K时已知的变化为MgCO3·3H2O→Mg5 (OH)2 (CO3)4· 4H2O,同时生成的产物只可能是CO2、H2O,配平得5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。正确答案:313K以下(或293K~313K)、5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。
,则c(OH-)=1×10-9mol/L,c(H+)=1×10-5mol/L,pH=5。既当溶液pH=5时,Al(OH)3开始沉淀,而pH=8.5时,Mg(OH)2开始沉淀,因此为了除去Al3+并确保Mg2+不损失,需控制溶液pH为5~8.5。正确答案:MgO(或Mg(OH)2、或MgCO3、或Mg2(OH)2 CO3)、5.0~8.5(或5.0<pH<8.5)。(5)从图中可以得知,当温度升高至313K以上, MgCO3·3H2O就有可能发生反应,323K既更高温度下,MgCO3·3H2O转变成Mg5 (OH)2 (CO3)4· 4H2O,影响产品质量。所以温度应当控制在313K以下。323K时已知的变化为MgCO3·3H2O→Mg5 (OH)2 (CO3)4· 4H2O,同时生成的产物只可能是CO2、H2O,配平得5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。正确答案:313K以下(或293K~313K)、5MgCO3·3H2O =Mg5 (OH)2 (CO3)4· 4H2O+CO2↑+10H2O。


科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
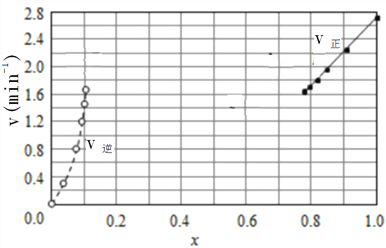
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为()
A. Na2SiO3 B. Na2SiO3与Na2CO3
C. SiO2与Na2CO3 D. SiO2、Na2SiO3及Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸的黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)是工业三废之一,其综合利用是一条变废为宝的重要途径。
I.以黄铁矿烧渣为原料制备颜料铁红(Fe2O3)和回收(NH4)2SO4的生产工艺流程如下图:
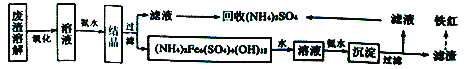
请回答下列问题:
(1)能提高“废渣溶解”速率的措施有______(写出一条即可),“氧化”的目的是______________。 (2)(NH4)2Fe6(SO4)4(OH)12中Fe的化合价是__________________。
(3)该工艺流程图中,第二次加入氨水后,反应的离子方程式为________________________。
II.下图是以黄铁矿烧渣为原料制备颜料铁红的另外一种生产工艺流程:
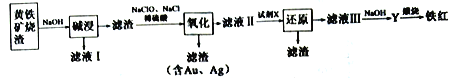
(4)在滤液I中加入廉价的熟石灰,反应的化学方程式是___________________。
(5)“氧化”反应较多,其中FeS 可以看做被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS 与Cl2 反应的离子方程式为________________。
(6)试剂X 为过量铁粉,其作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在25mL0.1mol/LNaOH 溶液中逐滴加入0.2mol/LCH3COOH 溶液,下图曲线所示的有关粒子浓度关系错误的是
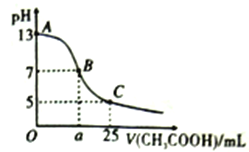
A. 任一点一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. B点:a=12.5,c(Na+ ) =c(CH3COO-)>c(OH-)= c(H+)
C. C点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+ )=0.1mol/L
D. C点:c(CH3COO-):c(CH3COOH))=3:2,则CH3COOH的Ka=1.5×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是胶体 ②是溶液 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜
A. ①③⑤ B. ②③④ C. ②③⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分

下列说法正确的是( )
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D. 使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与__________个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是__________
(3)—定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为__________
(4)某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com