
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol/L K2SO4溶液中含有的K+数为0.2NA
B.标准状况下,11.2LH2O中含有的分子数为0.5NA
C.32g由O2和O3组成的混合气体中含有的原子数为2NA
D.1molCl2与足量的铁粉完全反应,转移的电子数为3NA
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
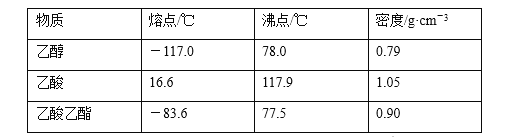
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
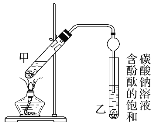
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
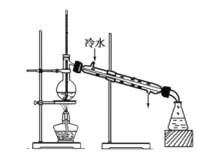
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组:按题目要求填写下列空白。
(1) 用价层电子对互斥模型预测下列微粒的立体结构,并指出后两种物质中中心原子的杂化方式。
H2Se______________ CF4_______________SO2______________ 、______SO42-______________、_______
(学法题)简述价层电子对互斥模型与分子的立体结构之间的关系_________________________
(2)写出下列物质的系统命名:
①(CH3)3COH________________②CH3CHClCOOH ___________________
③![]() ________________ ④
________________ ④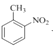 ________________
________________
(3)下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
① 6 C轨道表示为![]()
②7N轨道表示为:![]()
③29 Cu电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2
④20 Ca电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 2
⑤O: ![]()
(学法题)在解答此题时必须明确概念,简述泡利原理,洪特规则的概念:___________________________
(4)按要求书写化学方程式
①CH3CH(OH)CH3的催化氧化:__________________________________________
②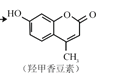 和氢氧化钠溶液反应____________________________________________
和氢氧化钠溶液反应____________________________________________
③过量乙酸与甘油的酯化反应_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
2CO(g)+2H2(g) 的△H =_____________kJ·mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是______。

②为了提高该反应中CH4的转化率,可以采取的措施是________。
(3)Li2O、Na2O、MgO均能吸收CO2 ;
①如果寻找吸收CO2的其他物质,下列建议不合理的是______
a.可在具有强氧化性的物质中寻找
b.可在碱性氧化物中寻找
c.可在ⅠA、ⅡA族元素形成的氧化物中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2 ,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_____________。
(4)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:

CO2在电极a放电的电极反应式是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
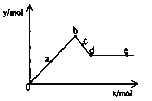
A. a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B. c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C. a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D. d—e时溶液中离子的物质的量:Ba2+不能等于OH–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:____________________________。
(2)下列操作会使配制的KOH溶液的物质的量浓度偏大的是_______
A、转移溶液后未洗涤烧杯和玻璃棒就直接定容
B、转移溶液过程中有液体溅出容量瓶
C、定容时俯视刻度线
D、配制溶液定容摇匀后发现容量瓶中液面低于刻度线,又补足了水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
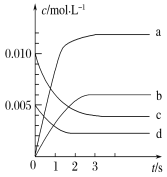
(2)能说明该反应已达到平衡状态的是________(填字母,下同)。
a. v(NO2)、v(O2)、v(NO)相等
b. 容器内各物质浓度保持不变
c. 该反应v逆=v正
d. 容器内总质量保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a 及时分离出NO2气体 b 适当升高温度
c 增大O2的浓度 d 选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com