
【题目】易混易错题组:按题目要求填写下列空白。
(1) 用价层电子对互斥模型预测下列微粒的立体结构,并指出后两种物质中中心原子的杂化方式。
H2Se______________ CF4_______________SO2______________ 、______SO42-______________、_______
(学法题)简述价层电子对互斥模型与分子的立体结构之间的关系_________________________
(2)写出下列物质的系统命名:
①(CH3)3COH________________②CH3CHClCOOH ___________________
③![]() ________________ ④
________________ ④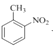 ________________
________________
(3)下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
① 6 C轨道表示为![]()
②7N轨道表示为:![]()
③29 Cu电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2
④20 Ca电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 2
⑤O: ![]()
(学法题)在解答此题时必须明确概念,简述泡利原理,洪特规则的概念:___________________________
(4)按要求书写化学方程式
①CH3CH(OH)CH3的催化氧化:__________________________________________
②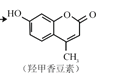 和氢氧化钠溶液反应____________________________________________
和氢氧化钠溶液反应____________________________________________
③过量乙酸与甘油的酯化反应_________________________________________________
【答案】四面体 正四体 平面三角形 sp2 正四面体 sp3 VSEPR模型可用来预测分子的立体构型,注意实际空间构型要去掉孤电子对 2-甲基-2-丙醇 2-氯丙酸 3-乙基戊烷 2-硝基甲苯 ⑤ ② ③ ④ 泡利原理为每个原子轨道上最多只能容纳2个自旋状态相反的电子;洪特规则为洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同; 2 CH3CH(OH)CH3+O2![]() 2 CH3COCH3+ 2H2O
2 CH3COCH3+ 2H2O 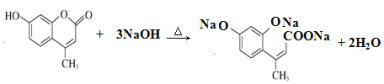

【解析】
(1) H2Se中心原子Se原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为四面体;CF4中心原子C原子形成4个σ键、含有2对孤对电子,故杂化轨道数为4,采取sp3杂化,故空间结构为正四体形;SO2中心原子上的孤对电子数为![]() =1,价层电子对个数为2,杂化轨道数为3,采取,故采取sp2杂化,空间结构为平面三角形;SO42-中含孤电子对为
=1,价层电子对个数为2,杂化轨道数为3,采取,故采取sp2杂化,空间结构为平面三角形;SO42-中含孤电子对为![]() =0,价层电子对个数都是4,故采取sp3杂化,所以空间构型都是正四面体结构;根据价层电子对互斥模型用来预测分子的立体构型,注意实际空间构型要去掉孤电子对;
=0,价层电子对个数都是4,故采取sp3杂化,所以空间构型都是正四面体结构;根据价层电子对互斥模型用来预测分子的立体构型,注意实际空间构型要去掉孤电子对;
(2)①根据系统命名法,有机物(CH3)3COH的名称为2-甲基-2-丙醇;②CH3CHClCOOH 的名称为2-氯丙酸;③![]() 的名称为3-乙基戊烷;④
的名称为3-乙基戊烷;④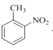 的名称为2-硝基甲苯;
的名称为2-硝基甲苯;
(3)①洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则6 C轨道表达式为![]() ;②洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则7N轨道表示为
;②洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,则7N轨道表示为![]() 时违背洪特规则;③当电子排布为全充满、半充满或全空时相对稳定,则29 Cu电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2时违背了洪特规则特例;④能量最低原理是原子核外电子先占有能量低的轨道,然后依次进入能量高的轨道,则20 Ca电子排布式为:1s22s 22p63s23p 63d2违背了能量最低原理,其正确的电子排布式为1s22s 22p63s23p 64s2;⑤泡利不相容原理是指每个原子轨道上最多只能容纳2个自旋状态相反的电子,则O:
时违背洪特规则;③当电子排布为全充满、半充满或全空时相对稳定,则29 Cu电子排布式为1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2时违背了洪特规则特例;④能量最低原理是原子核外电子先占有能量低的轨道,然后依次进入能量高的轨道,则20 Ca电子排布式为:1s22s 22p63s23p 63d2违背了能量最低原理,其正确的电子排布式为1s22s 22p63s23p 64s2;⑤泡利不相容原理是指每个原子轨道上最多只能容纳2个自旋状态相反的电子,则O: ![]() 违背泡利不相容原理;
违背泡利不相容原理;
故违背“泡利不相容原理”的是⑤;违背“洪特规则”的是②;违背“洪特规则特例”的是③;违背“能量最低原理”的是④;
在解答此题时必须明确概念,其中泡利原理为每个原子轨道上最多只能容纳2个自旋状态相反的电子;洪特规则为洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
(4)①CH3CH(OH)CH3在Cu作催化剂的条件下加热催化氧化生成丙酮,发生反应的化学方程式为2 CH3CH(OH)CH3+O2![]() 2 CH3COCH3+ 2H2O;
2 CH3COCH3+ 2H2O;
②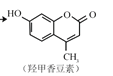 和氢氧化钠溶液反应时发生反应的化学方程式为
和氢氧化钠溶液反应时发生反应的化学方程式为 ;
;
③过量乙酸与甘油的酯化反应的化学方程式为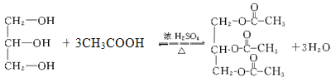 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
![]()
下列说法中不正确的是
A.500s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1 >T2,则K1>K2
D.平衡后,其他条件不变,将容器体积压缩到原来的![]() ,则c(NO2)<5.00mol·L-1
,则c(NO2)<5.00mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。
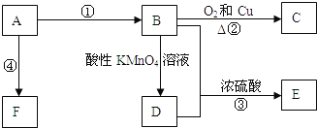
(1)A的电子式为:____________,C的名称:_____________,E的名称:____________ F的结构简式:________________。
(2)D分子中的官能团名称是____________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:___________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
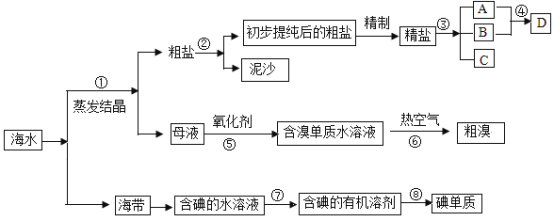
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②_______⑧_______。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是_____。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式_________________。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是_________。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是___________。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______性,该方法对比有机溶剂萃取法的优点是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。
⑥做过银镜反应实验后的试管,用氨水洗涤。
A. ①②④⑤⑥ B. ①②③④ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3②CH2=CHCH3和CH2=CH-CH=CH2③![]() 和
和![]() ④
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3⑥
⑤CH3CH2CH3和CH3C(CH3)3⑥![]() 和质量数为238中子数为146的原子⑦
和质量数为238中子数为146的原子⑦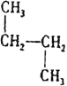 和
和![]() ⑧
⑧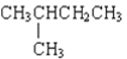 和CH3(CH2)3CH3
和CH3(CH2)3CH3
属于同系物的是______;填序号,下同属于同分异构体的是______;属于同位素的是______;属于同素异形体的是______;属于同种物质的是______。
(2)写出下列有机物的官能团的名称.
①![]() ____________;②
____________;②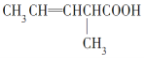 ___________;
___________;
(3)①由乙烯制一氯乙烷;②乙烯使酸性高锰酸钾溶液褪色;③乙烷在光照下与氯气反应;④乙烯使溴水褪色。在以上反应中,属于取代反应的是______(填序号,下同);属于加成反应的是______;属于氧化反应的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol/L K2SO4溶液中含有的K+数为0.2NA
B.标准状况下,11.2LH2O中含有的分子数为0.5NA
C.32g由O2和O3组成的混合气体中含有的原子数为2NA
D.1molCl2与足量的铁粉完全反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铝铁(PAFS)是一种高效净水剂,其组成表示为[AlFe(OH)x(SO4)(3-![]() )]y。为检测PAFS中Al的含量,设计如下流程。
)]y。为检测PAFS中Al的含量,设计如下流程。

回答下列问题:
(1)实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为__。
(2)PAFS中铁元素的化合价为_______;沉淀A的化学式为_________。
(3)如图所示,过滤操作中的一处错误是__________。
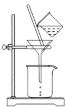
(4)生成沉淀B的离子方程式为______。
(5)PAFS中Al元素的质量分数为_______(用同m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础。下列与“物质的量”相关的计算正确的( )
A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1
B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com