
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
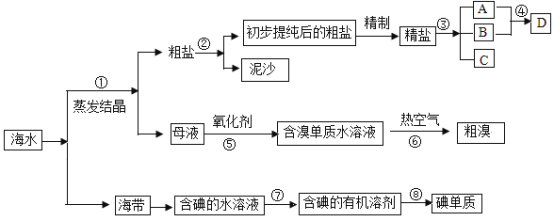
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②_______⑧_______。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是_____。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式_________________。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是_________。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是___________。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______性,该方法对比有机溶剂萃取法的优点是________________________。
【答案】过滤 蒸馏 分液漏斗 Cl2+2NaOH=NaCl+NaClO+H2O AD C 挥发 经济,环保,方便
【解析】
(1)步骤②为过滤,⑧为从有机溶剂中提取碘单质,需要蒸馏,答案为:过滤,蒸馏;
(2)步骤⑦分离提纯方法为萃取,主要玻璃仪器为分液漏斗、烧杯,答案为:分液漏斗;
(3)反应④是氯气和氢氧化钠反应生成次氯酸钠、氯化钠和水,方程式Cl2+2NaOH=NaCl+NaClO+H2O;
(4)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会同时除去过量的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为②③④①或③②④①,答案为:AD;
(5)若要提取Br2,反应⑤所用的氧化剂为氯气,本厂电解氯化钠溶液生产烧碱,产物中有氯气,答案为:C;
(6)溴单质具有挥发性,所以流程⑥将溴单质从水溶液中分离出来是基于溴单质具有挥发性;该方法对比有机溶剂萃取法的优点是经济,环保,方便


科目:高中化学 来源: 题型:
【题目】实验室需要480mL0.2mol·L-1的氢氧化钠溶液,下列说法正确的是( )
A.用托盘天平称取3.8gNaOH固体
B.若其他操作正确,将NaOH固体放在烧杯中溶解后,立即转移至容量瓶中定容,所得溶质物质的量浓度偏大
C.若其他操作正确,定容摇匀后,溶液凹液面最低点低于刻度线,用胶头滴管加水至刻度线,所得溶质物质的量浓度偏大
D.用0.8mol·L-112mLNaOH溶液稀释成480mL即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
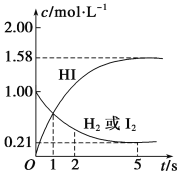
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
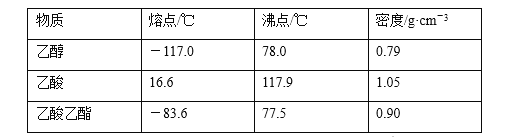
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
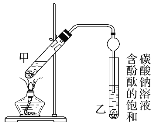
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
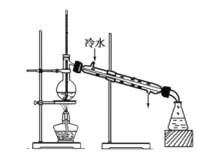
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是生活中常见的有机物,下列有关乙醇的实验操作或实验现象正确的是
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛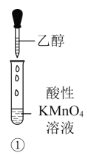
B.②中钠会在乙醇内部上下跳动,上方的火焰为淡蓝色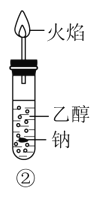
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色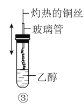
D.④中X是饱和NaOH溶液,X液面上有油状液体生成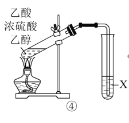
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组:按题目要求填写下列空白。
(1) 用价层电子对互斥模型预测下列微粒的立体结构,并指出后两种物质中中心原子的杂化方式。
H2Se______________ CF4_______________SO2______________ 、______SO42-______________、_______
(学法题)简述价层电子对互斥模型与分子的立体结构之间的关系_________________________
(2)写出下列物质的系统命名:
①(CH3)3COH________________②CH3CHClCOOH ___________________
③![]() ________________ ④
________________ ④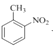 ________________
________________
(3)下列原子核外电子排布中,违背“泡利不相容原理”的是_________;违背“洪特规则”的是_______;违背“洪特 规则特例”的是___________。违背“能量最低原理”的是________;(填编号)
① 6 C轨道表示为![]()
②7N轨道表示为:![]()
③29 Cu电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2
④20 Ca电子排布式为:1s 2 2s 2 2p 6 3s 2 3p 6 3d 2
⑤O: ![]()
(学法题)在解答此题时必须明确概念,简述泡利原理,洪特规则的概念:___________________________
(4)按要求书写化学方程式
①CH3CH(OH)CH3的催化氧化:__________________________________________
②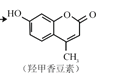 和氢氧化钠溶液反应____________________________________________
和氢氧化钠溶液反应____________________________________________
③过量乙酸与甘油的酯化反应_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某工厂的生产流程:
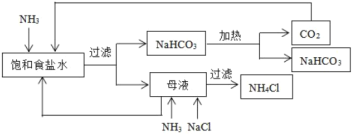
下列分析正确的是( )
A.母液中只含有:NH3和CO2B.母液中只含有:NH4+和Cl-
C.向母液中通NH3、加NaCl时加热D.该工厂的产品是纯碱和NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com