
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
【答案】K=![]() 减小
减小 ![]() c cd
c cd
【解析】
(1)根据化学平衡常数的含义书写表达式,结合温度与平衡移动的关系分析K的变化规律;
(2)速率之比等于方程式的计量系数之比,先求出用甲醇表示的速率之比再根据速率之比等于方程式的计量系数之比求解;
(3)判断可逆反应达到化学平衡状态的标志,一个是“等”也就是正反应速率等于逆反应速率;一个是“定”也就是物质的百分含量等保持不变,抓住反应中时刻改变的量不变时,反应达到平衡;
(4)缩小容器的体积相当于加压,平衡向系数减小的方向移动,然后根据平衡的移动分析求解。
(1)可逆反应CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数K=
CH3OH(g)的化学平衡常数K=![]() ,从图象可知温度升高,CH3OH的平衡含量降低,说明升高温度平衡逆向移动,因此该反应的化学平衡常数K值减小;
,从图象可知温度升高,CH3OH的平衡含量降低,说明升高温度平衡逆向移动,因此该反应的化学平衡常数K值减小;
(2)v(CH3OH)= ,由于同一反应用不同物质表示反应速率时,速率比等于化学方程式中的化学计量数的比,所以v(H2)=2v(CH3OH)=2×
,由于同一反应用不同物质表示反应速率时,速率比等于化学方程式中的化学计量数的比,所以v(H2)=2v(CH3OH)=2×![]() ;
;
(3)a.都表示的正反应方向的速率关系不能判断正逆反应速率是否相等,a错误;
b.ρ=![]() ,m是气体的总质量,反应过程中始终保持不变,v是定值,所以ρ始终不变,不能用来判断是否达到平衡,b错误;
,m是气体的总质量,反应过程中始终保持不变,v是定值,所以ρ始终不变,不能用来判断是否达到平衡,b错误;
c.M=![]() ,m是气体的总质量,反应过程中始终保持不变,n是气体的物质的量之和,反应前后气体系数不同,故可根据物质的相对分子质量M可以用来判断是否达到平衡,c正确;
,m是气体的总质量,反应过程中始终保持不变,n是气体的物质的量之和,反应前后气体系数不同,故可根据物质的相对分子质量M可以用来判断是否达到平衡,c正确;
d.各种物质的浓度之比等于方程式中相应物质的化学计量数之比时,反应可能处于平衡状态,也可能未处于平衡状态,这与反应开始时加入的物质的量的多少有关,因此不可以作为达到平衡的标准,d错误;
故合理选项是c;
(4)缩小容器的体积相当于加压,平衡向系数减小的方向移动。
a.增大压强,c(H2)应该先增大后减小,但是比原来的大,a错误;
b.缩小体积反应物、生成物浓度都增大,所以正、逆反应速率都增大,b错误;
c.缩小容器的体积相当于加压,平衡向系数减小的方向移动,即向正方向移动,甲醇的物质的量增加,c正确;
d.化学平衡常数K=![]() ,
,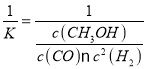 =
=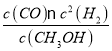 ,缩小容器的体积,c(CO)浓度先是由于缩小容积而变大后由于平衡正向移动而变小,但是最终达到平衡时比原来的大,因为温度不变所以
,缩小容器的体积,c(CO)浓度先是由于缩小容积而变大后由于平衡正向移动而变小,但是最终达到平衡时比原来的大,因为温度不变所以![]() 不变,所以重新平衡时
不变,所以重新平衡时![]() 减小,d正确;
减小,d正确;
故合理选项是cd。


科目:高中化学 来源: 题型:
【题目】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为________。
(2)SO42-的空间构型为_______(用文字描述)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为______;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol·L-1CH3COOH溶液中慢慢加入NaOH固体。CH3COOH与CH3COO-的浓度变化趋势如图所示(不考虑溶液体积和温度的变化)。n(NaOH)=0.001mol时,溶液呈酸性。下列说法正确的是
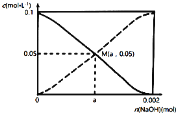
A.当n(NaOH)=0.002mol时,c(CH3COO-)>c(Na+)>c(CH3COOH)
B.在M点时,n(OH-)-n(H+)=a-0.05
C.a<0.001mol
D.当n(NaOH)=0.001mol时,c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A. 易溶于水,常温下为液体
B. 在空气中燃烧产生黑烟
C. 它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D. 能发生加成反应,在一定条件下可与4倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。
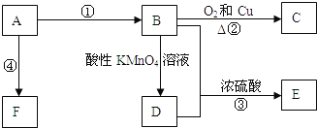
(1)A的电子式为:____________,C的名称:_____________,E的名称:____________ F的结构简式:________________。
(2)D分子中的官能团名称是____________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:___________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
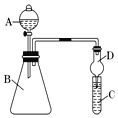
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-、I-、SO42-、Na+、Mg2+、Ca2+等,都是重要资源.开发和利用海水资源是当前科学研究的一项重要任务,如图是某化工厂对海水资源综合利用的示意图:
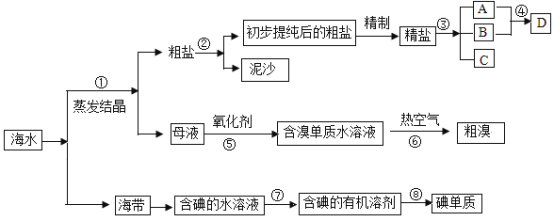
请根据以上信息回答下列问题:
(1)写出步骤②、⑧分离提纯的方法:
②_______⑧_______。
(2)步骤⑦分离提纯过程中需要选用的玻璃仪器除烧杯外,还需要的仪器是_____。
(3)D具有杀菌消毒的作用,请写出反应④的化学方程式_________________。
(4)初步提纯后的粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
①盐酸 ②氯化钡溶液 ③氢氧化钠溶液 ④碳酸钠溶液,
下列试剂添加顺序合理的是_________。
A.②③④① B.③④②① C.④③②① D.③②④①
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是___________。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______性,该方法对比有机溶剂萃取法的优点是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列各组物质:
①O2和O3②CH2=CHCH3和CH2=CH-CH=CH2③![]() 和
和![]() ④
④![]() 和
和![]() ⑤CH3CH2CH3和CH3C(CH3)3⑥
⑤CH3CH2CH3和CH3C(CH3)3⑥![]() 和质量数为238中子数为146的原子⑦
和质量数为238中子数为146的原子⑦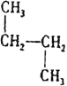 和
和![]() ⑧
⑧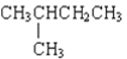 和CH3(CH2)3CH3
和CH3(CH2)3CH3
属于同系物的是______;填序号,下同属于同分异构体的是______;属于同位素的是______;属于同素异形体的是______;属于同种物质的是______。
(2)写出下列有机物的官能团的名称.
①![]() ____________;②
____________;②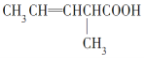 ___________;
___________;
(3)①由乙烯制一氯乙烷;②乙烯使酸性高锰酸钾溶液褪色;③乙烷在光照下与氯气反应;④乙烯使溴水褪色。在以上反应中,属于取代反应的是______(填序号,下同);属于加成反应的是______;属于氧化反应的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. ClO3-的空间构型为平面三角形B. SF6中有6对相同的成键电子对
C. 含π键的物质不如只含σ键的物质稳定D. SiF4和SO32-的中心原子均为sp2杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com