
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:
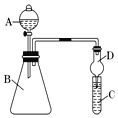
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
【答案】K Al S2﹣+Cl2═S↓+2Cl﹣ 变蓝 防止溶液倒吸 NaOH D Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3
【解析】
I.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式;
Ⅱ.(1)氯气能够将碘离子氧化成碘单质;球形干燥管具有防止倒吸的作用;氯气有毒,氯气能够与氢氧化钠溶液反应;
(2)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰。
Ⅰ.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,则需要2mol钠(46g),2mol钾(78g),1mol镁(24g),![]() mol铝(18g),所以金属质量相同时,生成氢气最多的是金属铝;
mol铝(18g),所以金属质量相同时,生成氢气最多的是金属铝;
(2)氯气氧化性强于硫单质,则氯气能够氧化硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-;
Ⅱ.(1)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝色;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;氯气有毒,不能排放到空气中,可用氢氧化钠溶液进行尾气吸收;
(2)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸,干扰实验结果,需要将二氧化碳中的氯化氢除掉;根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和D之间增加装有饱和NaHCO3溶液的洗气瓶,改进后C中发生反应的化学方程式是Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,以MnO2为原料制得的MnCl2溶液中常合有Cu2+、Pb2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-→CuS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的数据,下列判断正确的是
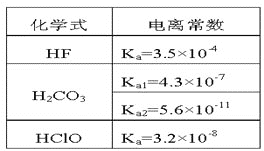
A.同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3
B.结合H+的能力:ClO->CO32->F-
C.次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+H2O+CO2=HClO+HCO3-
D.碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.3NA
C.11克D218O中含有的中子为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是生活中常见的有机物,下列有关乙醇的实验操作或实验现象正确的是
A.①中酸性KMnO4溶液会褪色,乙醇转化为乙醛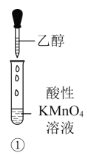
B.②中钠会在乙醇内部上下跳动,上方的火焰为淡蓝色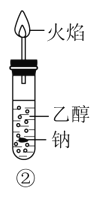
C.③中灼热的铜丝插入乙醇中,铜丝由红色变为黑色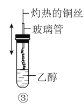
D.④中X是饱和NaOH溶液,X液面上有油状液体生成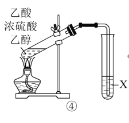
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: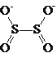 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
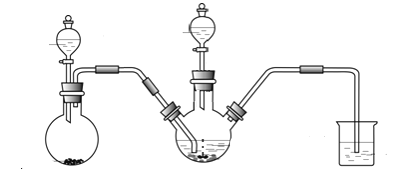
(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
![]()
A. N4分子的键角为109°28′B. N4的沸点比N2低
C. 1 mol N4分子所含共价键数为4NAD. N4分子中只含有非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com