
【题目】常温下,向20.00mL0.1000mol·L-1CH3COOH溶液中慢慢加入NaOH固体。CH3COOH与CH3COO-的浓度变化趋势如图所示(不考虑溶液体积和温度的变化)。n(NaOH)=0.001mol时,溶液呈酸性。下列说法正确的是
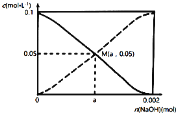
A.当n(NaOH)=0.002mol时,c(CH3COO-)>c(Na+)>c(CH3COOH)
B.在M点时,n(OH-)-n(H+)=a-0.05
C.a<0.001mol
D.当n(NaOH)=0.001mol时,c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
【答案】C
【解析】
20.00mL0.1000mol/LCH3COOH溶液中含有CH3COOH的物质的量是0.002mol,加入氢氧化钠0.001mol时,溶液中含有的CH3COOH和CH3COONa均为0.001mol,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度。
A.加入NaOH0.002mol时,恰好完全反应生成醋酸钠,由于醋酸根离子发生水解作用,溶液中c(Na+)>c(CH3COO-)>c(CH3COOH),A错误;
B.根据分析,当加入NaOH0.001mol溶液显酸性,溶液中c(CH3COOH)<c(CH3COO-),M点时c(CH3COOH)=c(CH3COO-),说明加入氢氧化钠少于0.001mol,根据电荷守恒,n(OH-)+n (CH3COO-)= c(Na+)+n(H+),可得n(OH-)- n(H+)= c(Na+)-n (CH3COO-)=(a-0.001)mol,B错误;
C.结合B分析可知,要想使溶液中c(CH3COOH)=c(CH3COO-),说明加入氢氧化钠一定要少于0.001mol,C正确;
D.根据电荷守恒,n(OH-)+n(CH3COO-)=c(Na+)+n(H+)①,根据物料守恒得2c(Na+)=c (CH3COO-)+c(CH3COOH)②,结合①②得2c(H+)+c(CH3COOH)= n(CH3COO-)+2c(OH-),D错误;
故合理选项是C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于____(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是____(填字母)。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为____、糖类和蛋白质。淀粉在人体内水解的最终产物是____。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是____,甜味剂是___。泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___反应释放出了气体。

(3)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的SO2排放,能够减少____型酸雨的形成。燃煤排放的烟气中还含有其他污染物,请列举一种:_____。
②燃煤产生的CO2用NH3处理可生产多种化工产品。用氨水吸收CO2可制得碳铵(NH4HCO3),写出该反应的化学方程式_____。用液氨与CO2反应可制备尿素[CO(NH2)2]。尿素和碳铵这两种氮肥中,氮元素的质量分数较高的是_____。
③煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL0.2mol·L-1的氢氧化钠溶液,下列说法正确的是( )
A.用托盘天平称取3.8gNaOH固体
B.若其他操作正确,将NaOH固体放在烧杯中溶解后,立即转移至容量瓶中定容,所得溶质物质的量浓度偏大
C.若其他操作正确,定容摇匀后,溶液凹液面最低点低于刻度线,用胶头滴管加水至刻度线,所得溶质物质的量浓度偏大
D.用0.8mol·L-112mLNaOH溶液稀释成480mL即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
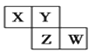
A. 元素Y和元素Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C. 元素Y和元素Z的氢化物中均只存在极性共价键
D. 元素W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的数据,下列判断正确的是
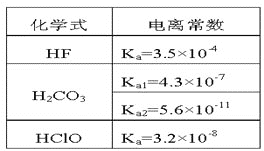
A.同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3
B.结合H+的能力:ClO->CO32->F-
C.次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+H2O+CO2=HClO+HCO3-
D.碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
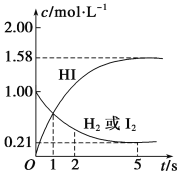
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com