
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是( )

A.a棉球褪色,验证SO2具有氧化性
B.c棉球蓝色褪去,验证SO2漂白性
C.b棉球褪色,验证SO2具有酸性氧化物的通性
D.可以使用浓硫酸吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
4NO2(g)+O2(g) △H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表:
![]()
下列说法中不正确的是
A.500s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1 >T2,则K1>K2
D.平衡后,其他条件不变,将容器体积压缩到原来的![]() ,则c(NO2)<5.00mol·L-1
,则c(NO2)<5.00mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B. 已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2
C. 已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
D. 已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol·L-1CH3COOH溶液中慢慢加入NaOH固体。CH3COOH与CH3COO-的浓度变化趋势如图所示(不考虑溶液体积和温度的变化)。n(NaOH)=0.001mol时,溶液呈酸性。下列说法正确的是
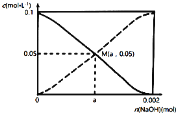
A.当n(NaOH)=0.002mol时,c(CH3COO-)>c(Na+)>c(CH3COOH)
B.在M点时,n(OH-)-n(H+)=a-0.05
C.a<0.001mol
D.当n(NaOH)=0.001mol时,c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
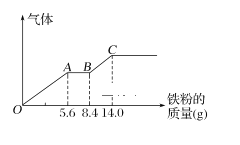
A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。
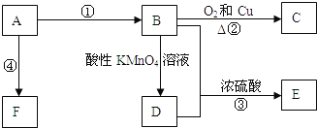
(1)A的电子式为:____________,C的名称:_____________,E的名称:____________ F的结构简式:________________。
(2)D分子中的官能团名称是____________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:___________,反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol/L K2SO4溶液中含有的K+数为0.2NA
B.标准状况下,11.2LH2O中含有的分子数为0.5NA
C.32g由O2和O3组成的混合气体中含有的原子数为2NA
D.1molCl2与足量的铁粉完全反应,转移的电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com