
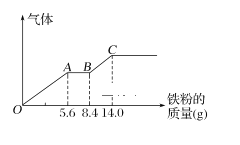
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )
A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 molL-1
【答案】A
【解析】
第一份混合酸中加入铜粉发生反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,9.6gCu的物质的量=![]() =0.15mol,根据计量数可得同时消耗0.4mol H+和0.1mol NO3-;
=0.15mol,根据计量数可得同时消耗0.4mol H+和0.1mol NO3-;
第二份混合酸中有关粒子的氧化性强弱顺序为:HNO3>Fe3+>H+,因此铁粉加到第二份混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,分别对应图像上OA段,AB段,BC段。由此分析。
A.根据有关粒子的氧化性强弱顺序:HNO3>Fe3+>H+,铁粉加到100mL混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,即对应图像上OA段,AB段,BC段的反应。OA段消耗铁粉的物质的量=![]() =0.1mol,根据反应计量关系可知同时消耗0.4molH+,0.1molNO3-,由于BC段有H2放出,说明OA段溶液中H+过量,因此0.1mol NO3-耗尽后没有剩余,所以原200mL混合酸中含有的NO3-的物质的量=0.1mol×2=0.2mol,A项错误;
=0.1mol,根据反应计量关系可知同时消耗0.4molH+,0.1molNO3-,由于BC段有H2放出,说明OA段溶液中H+过量,因此0.1mol NO3-耗尽后没有剩余,所以原200mL混合酸中含有的NO3-的物质的量=0.1mol×2=0.2mol,A项错误;
B. 根据有关粒子的氧化性强弱顺序:HNO3>Fe3+>H+,铁粉加到混合酸中将依次发生三个反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,即对应图像上OA段,AB段,BC段的反应,所以OA段产生的气体是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气,B项正确;
C.根据上面的分析可知图像OA段、AB段、BC段对应的反应分别是:Fe+4H++NO3-=Fe3++NO↑+2H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,分析这三个离子反应可知混合酸和铁粉的转化:铁元素最终转化为Fe2+,氢元素最终转化为H2O或H2,NO3-最终转化为NO,SO42-没有参与反应,所以第二份溶液中最终溶质为FeSO4,C项正确;
D.根据上面的分析可知图像OA段、AB段、BC段对应的反应分别是:Fe+4H++NO3-=Fe3++NO↑+2H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑,OA段消耗铁粉的物质的量=![]() =0.1mol,根据反应计量数可得OA段消耗0.4molH+,0.1molNO3-;BC段消耗铁粉物质的量=
=0.1mol,根据反应计量数可得OA段消耗0.4molH+,0.1molNO3-;BC段消耗铁粉物质的量=![]() =0.1mol,根据反应计量数可得BC段消耗H+0.2mol,由此可知每份混合酸中含0.4mol+0.2mol =0.6mol H+,因含0.1molHNO3,则含H2SO4物质的量=
=0.1mol,根据反应计量数可得BC段消耗H+0.2mol,由此可知每份混合酸中含0.4mol+0.2mol =0.6mol H+,因含0.1molHNO3,则含H2SO4物质的量=![]() =0.25mol,硫酸的浓度=
=0.25mol,硫酸的浓度=![]() =2.5mol/L,D项正确;答案选A。
=2.5mol/L,D项正确;答案选A。


科目:高中化学 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
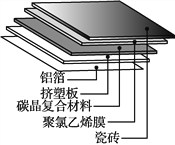
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)B中所发生反应的离子方程式为___。
(2)洗气装置C中所放试剂为饱和食盐水,其作用是___,D中所放试剂为紫色石蕊试液,可观察到的现象为___,产生该现象的原因是氯气与水发生了反应,反应的离子方程式为___。
(3)E中为红色干布条,F中为红色湿布条,用以验证干燥的氯气是否具有漂白性,实验设计是否合理___(填“是”或“否”),若不合理应如何改进?(认为合理则此问不用做答)___。
(4)G是浸有淀粉KI溶液的棉花球,可观察到的现象是棉花球表面变成___,H是浸有NaBr溶液的棉花球,该处反应的化学方程式为___。
(5)P为尾气吸收装置,所需试剂为__(填化学式)溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.硫化氢溶于水:H2S![]() 2H++S2-
2H++S2-
B.熔融状态下的NaHSO4:NaHSO4=Na++H++SO42-
C.碳酸氢钠溶于水:NaHCO3=HCO3-+Na+
D.醋酸溶于水:CH3COOH=CH3COO-+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
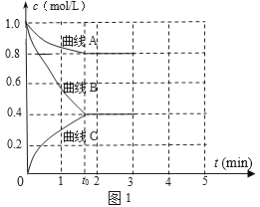
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
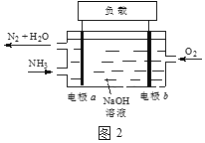
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】698 K时,向某V L的密闭容器中充入2 mol H2(g)和2 mol I2(g),发生反应:H2(g)+I2(g)2HI(g) ΔH=-26.5 kJ·mol-1,测得各物质的物质的量浓度与时间的变化关系如图所示。
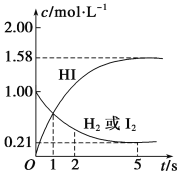
该反应达到平衡状态时,______(填“吸收”或“放出”)的热量为:____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①C6H5Cl ②(CH3)2CHCH2Cl ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH2Cl2
⑥CH2Cl2
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
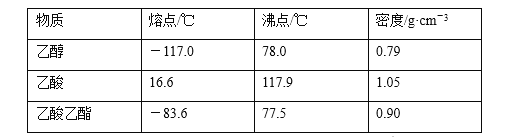
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥、蒸馏。最后得到纯净的乙酸乙酯。
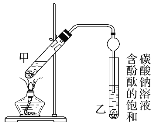
(1)反应中浓硫酸的作用是_________。
(2)写出制取乙酸乙酯的化学方程式:_________。
(3)上述实验中饱和碳酸钠溶液的作用是________。
(4)步骤②为防止加热过程中液体爆沸,该采取什么措施__________。
(5)欲将乙试管中的物质分离以得到乙酸乙酯,必须使用玻璃的仪器有____;分离时,乙酸乙酯应从仪器_____(填“下口放”或“上口倒”)出。
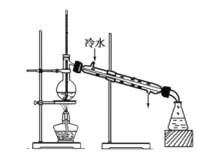
(6)通过分离后饱和碳酸钠中有一定量的乙醇,拟用图回收乙醇,回收过程中应控制温度是_____;找出图中的错误_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
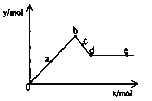
A. a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B. c—d时溶液中离子的物质的量:AlO2–比Ba2+多
C. a—d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D. d—e时溶液中离子的物质的量:Ba2+不能等于OH–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com