
| A、①② | B、②③ | C、③④ | D、①④ |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、Na+、Fe3+、SO42-、Cl- |
| B、Ba2+、Mg2+、HCO3-、NO3- |
| C、Na+、K+、NO3-、CO32- |
| D、K+、NO3-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
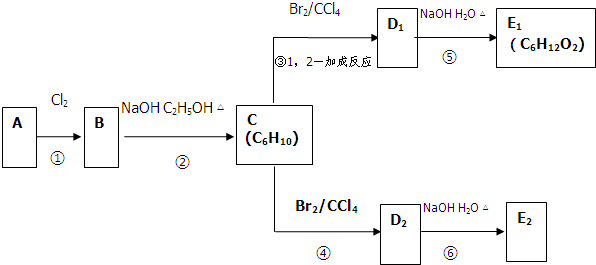
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
| A、上述反应中As2S3发生还原反应,作还原剂 |
| B、该反应的氧化产物为H3AsO4和S |
| C、该反应可以说明HNO3的酸性强于H3AsO4的酸性 |
| D、若生成2mol H3AsO4,则反应中转移电子的物质的量为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
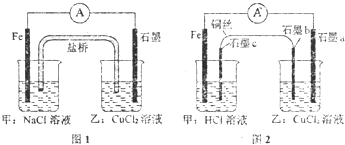 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
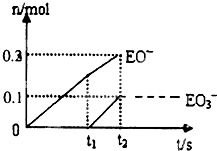 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com