
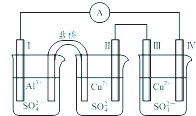
 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
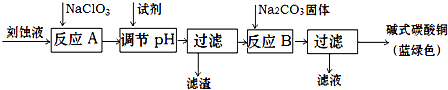
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 |
| B、甲烷的燃烧热△H=-890kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ?mol-1 |
| C、已知常温常压下:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 |
| D、已知:S(s)+O2(g)=SO2(g)△H1=-Q1 kJ?mol-1,S(g)+O2(g)=SO2(g)△H2=-Q2kJ?mol-1,则Q1<Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自然界中的一切物质的能量均来自太阳 |
| B、人体每摄入1摩尔葡萄糖,就为人体提供2870kJ能量 |
| C、人体所需的能量均来自于葡萄糖的氧化 |
| D、1摩尔固态葡萄糖和6摩尔氧气所含能量大于6摩尔CO2和6摩尔液态水所含的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
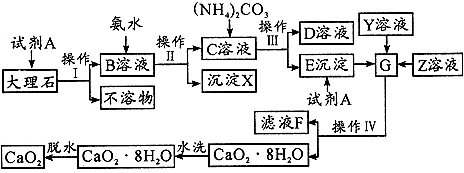
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com