
| 0.0006mol×72g/mol |
| 0.06g |


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
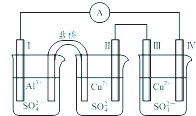 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用两根铜棒电解盐酸:2H++2Cl-
| ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3O2(g)═2H2O(g)+2CO2(g)△H=-2b kJ?mol-1 | ||||
| C、向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++HCO3-+OH-=CaCO3↓+2H2O | ||||
| D、在酸性碘化亚铁溶液中通入少量氧气:4I-+O2+4H+=2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、核裂变是一种化学变化 |
| B、131I 与127I互为同素异形体 |
| C、131I 原子的中子数为78 |
| D、碘在周期表中位于第四周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
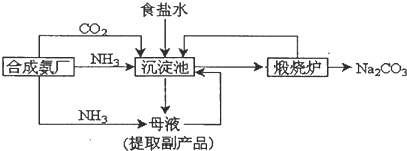
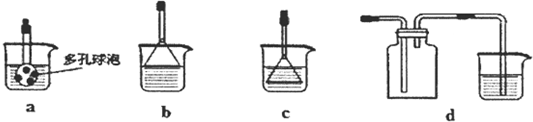
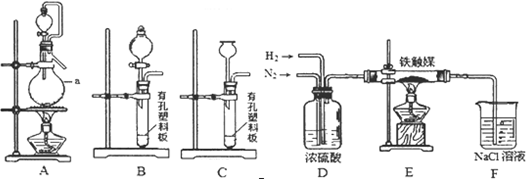
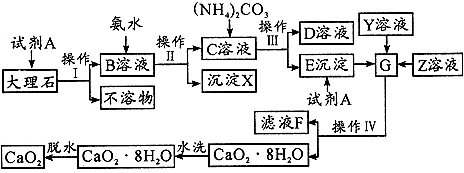
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、VA=0.5mol/(L.min) |
| B、VB=0.3mol/(L.min) |
| C、Vc=2.4mol/(L.min) |
| D、VD=1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
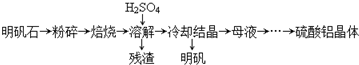
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com