
| ||
| ||
| ||


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
查看答案和解析>>
科目:高中化学 来源: 题型:
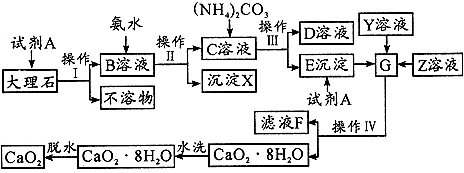
查看答案和解析>>
科目:高中化学 来源: 题型:
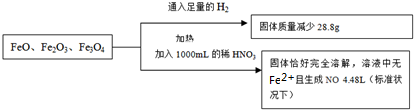
| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠和水的反应:Na+2H2O=Na++OH-+H2↑ |
| B、向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3+2HClO |
| C、过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
| D、过量的NaHSO4溶液与Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
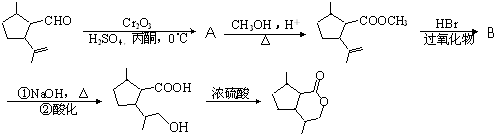
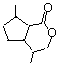 的同分异构体C的结构简式为
的同分异构体C的结构简式为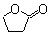 的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH
的合成路线图(无机试剂任选),合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com