
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
| 32g |
| 64g/mol |
| 32g |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )
已知A与B相互转化:2A(g)?B(g);△H=-24.4J/mol.在恒温下,将一定量的A和B混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图,下列推断合理的是( )| A、前10min内,用v(A)为0.02mol/(L?min) |
| B、反应进行前10min时,体系吸收热量9.76kJ |
| C、b、c、d三点中反应速率d>b=c |
| D、25min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷与氯气在光照条件下发生加成反应 |
| B、将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃 |
| C、甲苯能够使溴的四氯化碳溶液和酸性的高锰酸钾溶液褪色 |
| D、乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
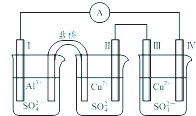 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其它均为Cu电极,则下列叙述正确的是( )| A、电子流动方向:电极Ⅳ→A→电极Ⅰ |
| B、电极Ⅰ发生氧化反应 |
| C、电极Ⅱ质量不变 |
| D、电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
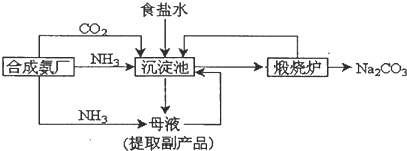
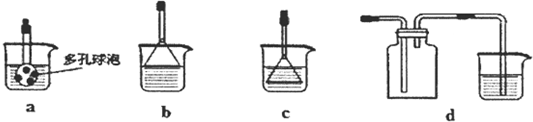
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com