
| A、核裂变是一种化学变化 |
| B、131I 与127I互为同素异形体 |
| C、131I 原子的中子数为78 |
| D、碘在周期表中位于第四周期ⅦA族 |


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )
短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )| A、D、F两种元素能形成如图所示的二聚分子,则该化合物的化学式是D2F6,为离子化合物,在熔融状态下能导电 |
| B、B、F两元素形成的氢化物稳定性中,B的氢化物比较稳定,其原因为其分子间存在氢键 |
| C、将标况下22.4L的X加入到足量的水中,完全吸收后得1mol的对应的酸 |
| D、用电解法可制得C、D、F的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O |
| B、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、NH4HCO3溶于过量的KOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
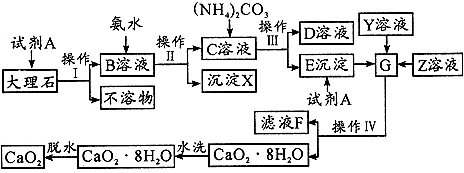
查看答案和解析>>
科目:高中化学 来源: 题型:
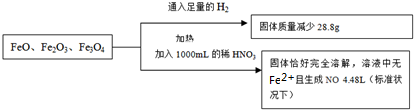
| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气与氯气见光发生爆炸,说明氢气与氯气具有的总能量小于氯化氢 |
| B、浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色物质生成且能溶于浓硝酸 |
| C、由于碳燃烧时放出大量的热,所以碳与氧气的反应不需要任何条件 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
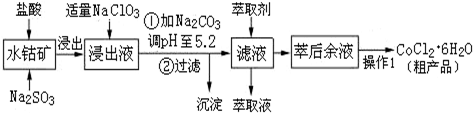
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com