
【题目】已知:![]() +CH2=CH-M
+CH2=CH-M![]() +HX(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
+HX(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:

(1)写出C中的含氧官能团的名称__,F→G的反应类型是__;
(2)写出A与银氨溶液反应的化学方程式:_______;
(3)D的结构简式为__;
(4)F有多种同分异构体,写出同时满足下列条件的F的一种同分异构体的结构简式:_____;
Ⅰ.分子中除苯环外,无其他环状结构;
Ⅱ.苯环上有两个处于对位的取代基;
Ⅲ..能发生水解反应,不能与金属Na反应;
Ⅳ.能与新制的Cu(OH)2按物质的量之比1:2发生反应;
(5)二氢香豆素(![]() )常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(![]() )需要用到的试剂有:NaOH溶液________、________;
)需要用到的试剂有:NaOH溶液________、________;
(6)已知:![]() R、R′为烃基),请写出以苯、丙烯(CH2═CHCH3)为原料制备
R、R′为烃基),请写出以苯、丙烯(CH2═CHCH3)为原料制备![]() 的合成路线流程图____________(无机试剂任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图____________(无机试剂任选).合成路线流程图示例如下:H2C═CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH。
CH3CH2OH。
【答案】酯基 酯化反应(取代反应) CH2=CHCHO+2Ag(NH3)2OH![]() CH2=CHCOONH4+2Ag↓+H2O+3NH3
CH2=CHCOONH4+2Ag↓+H2O+3NH3 ![]()
![]() 稀硫酸 氯化铁溶液
稀硫酸 氯化铁溶液 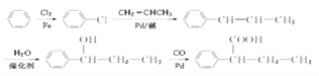
【解析】
由有机物A合成G(香豆素)的路线可知,A能发生银镜反应,则A为CH2=CHCHO,B为CH2=CHCOOH,B与甲醇发生酯化反应,C为CH2=CHCOOCH3,结合已知信息可知C+D→E,由E的结构可知,D为![]() ,E→F发生水解,F→G发生酯化反应;
,E→F发生水解,F→G发生酯化反应;
(1)根据分析可知:C的结构简式为CH2=CHCOOCH3,C中含C=C和﹣COOC﹣,含氧官能团为酯基,F→G发生酯化反应(取代反应);答案:酯基;酯化反应(取代反应);
(2)A与银氨溶液反应生成羧酸铵、Ag、水、氨气,该反应为CH2=CHCHO+2Ag(NH3)2OH![]() CH2=CHCOONH4+2Ag↓+H2O+3NH3,答案:CH2=CHCHO+2Ag(NH3)2OH
CH2=CHCOONH4+2Ag↓+H2O+3NH3,答案:CH2=CHCHO+2Ag(NH3)2OH![]() CH2=CHCOONH4+2Ag↓+H2O+3NH3。
CH2=CHCOONH4+2Ag↓+H2O+3NH3。
(3)由上述分析可知,D为![]() ;答案:
;答案:![]() 。
。
(4)F的同分异构体满足Ⅰ.分子中除苯环外,无其他环状结构;Ⅱ.苯环上有两个处于对位的取代基;Ⅲ.能发生水解反应,不能与金属Na反应;Ⅳ.能与新制的Cu(OH)2按物质的量之比1:2发生反应,则含由有﹣COOC﹣、﹣CHO或HCOOC﹣、﹣C﹣O﹣C﹣CH=CH2或HCOOC﹣、﹣COCH3;符合条件的同分异构体为![]() ;答案:
;答案: ![]() 。
。
(5)二氢香豆素的水解产物中含苯酚结构,利用苯酚的性质鉴别,所以试剂除NaOH外,还选用稀硫酸中和至酸性,选氯化铁溶液显紫色检验苯酚;答案:稀硫酸;氯化铁溶液;
(6)以苯、丙烯(CH2═CHCH3)为原料制备![]() ,先发生苯的取代,再结合信息可知,发生氯苯与的CH2═CHCH3反应,然后与水发生加成,最后与CO、Pb反应生成产物,合成路线流程图为
,先发生苯的取代,再结合信息可知,发生氯苯与的CH2═CHCH3反应,然后与水发生加成,最后与CO、Pb反应生成产物,合成路线流程图为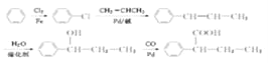 ;答案:
;答案: 。
。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
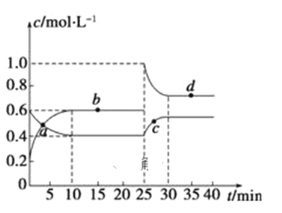
(1)该温度下,若温度升高,K值将___________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是_____点。
(3)25 min时,加入了___________填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_____(填“大于”、“小于”或“等于”)0.8 mol/L,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态.判断可逆反应达到平衡状态的标志是( )
CH3OH(g)达到平衡状态.判断可逆反应达到平衡状态的标志是( )
A.υ生成(CH3OH)=υ消耗(CO)B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变D.CO、H2、CH3OH的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
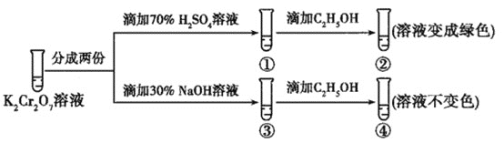
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
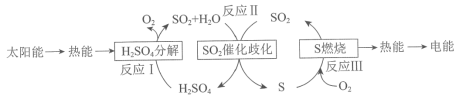
反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有“退热冰”之称的乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,纯乙酰苯胺是一种白色有光泽片状结晶,不仅本身是重要的药物,而且是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。实验室用苯胺与乙酸合成乙酰苯胺的反应和实验装置如图(夹持及加热装置略):
![]() +CH3COOH
+CH3COOH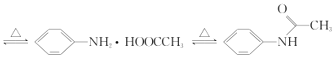 +H2O
+H2O
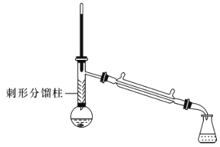
注:①苯胺与乙酸的反应速率较慢,且反应是可逆的。
②苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。
③刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
可能用到的有关性质如下:(密度单位为g/cm3)
名称 | 相对分子质量 | 性状 | 密度/gcm3 | 熔点/℃ | 沸点/ | 溶解度 | |
g/100g水 | g/100g乙醇 | ||||||
苯胺 | 93.12 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
冰醋酸 | 60.052 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
乙酰苯胺 | 135.16 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
合成步骤:
在50mL圆底烧瓶中加入10mL新蒸馏过的苯胺和15mL冰乙酸(过量)及少许锌粉(约0.1g)。用刺形分馏柱组装好分馏装置,小火加热10min后再升高加热温度,使蒸气温度在一定范围内浮动1小时。在搅拌下趁热快速将反应物以细流倒入100mL冷水中冷却。待乙酰苯胺晶体完全析出时,用布氏漏斗抽气过滤,洗涤,以除去残留酸液,抽干,即得粗乙酰苯胺。
分离提纯:
将粗乙酰苯胺溶于300mL热水中,加热至沸腾。放置数分钟后,加入约0.5g粉未状活性炭,用玻璃棒搅拌并煮沸10min,然后进行热过滤,结晶,抽滤,晾干,称量并计算产率。
(1)由于冰醋酸具有强烈刺激性,实验中要在__内取用,加入过量冰醋酸的目的是__。
(2)反应开始时要小火加热10min是为了__。
(3)实验中使用刺形分馏柱能较好地提高乙酰苯胺产率,试从化学平衡的角度分析其原因:__。
(4)反应中加热方式可采用__(填“水浴”“油浴”或"直接加热”),蒸气温度的最佳范围是__(填字母代号)。
a.100~105℃ b.117.9~184℃ c.280~290℃
(5)判断反应基本完全的现象是__,洗涤乙酰苯胺粗品最合适的试剂是__(填字母代号)。
a.用少量热水洗 b.用少量冷水洗
c.先用冷水洗,再用热水洗 d.用酒精洗
(6)分离提纯乙酰苯胺时,在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是__,若加入过多的活性炭,使乙酰苯胺的产率__(填“偏大”“偏小”或“无影响”)。
(7)该实验最终得到纯品7.36g,则乙酰苯胺的产率是__%(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是甲烷燃料电池原理示意图,回答下列问题:
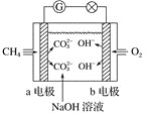
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2![]() -4e-===4CO2;
-4e-===4CO2;
正极反应式:__________________________________________;
总电池反应式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com