
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是( )
A. 该醋酸溶液的浓度为0.01mol/L
B. 加入少量CH3COONa固体,c(CH3COOH)增大
C. 溶液中离子浓度关系满足c(H+)>c(OH-)+c(CH3COO-)
D. 与等体积、pH=12的NaOH溶液混合后所得的溶液中c(Na+)=c(CH3COO-)
【答案】B
【解析】
A.醋酸是一元弱酸,所以常温下pH=2的醋酸溶液,c(CH3COOH)>c(H+)=0.01mol/L,A错误;
B.醋酸是一元弱酸,在溶液中存在电离平衡CH3COOH![]() CH3COO-+H+,向该溶液中加入少量CH3COONa固体,平衡逆向移动,但平衡移动的趋势是微弱的,当达到平衡时,溶液中c(CH3COOH)增大,B正确;
CH3COO-+H+,向该溶液中加入少量CH3COONa固体,平衡逆向移动,但平衡移动的趋势是微弱的,当达到平衡时,溶液中c(CH3COOH)增大,B正确;
C.根据电荷守恒,可得溶液中离子浓度关系满足c(H+)=c(OH-)+c(CH3COO-),C错误;
D.NaOH是一元强碱,pH=12的NaOH溶液中,c(NaOH)=c(OH-)=0.01mol/L,而醋酸是一元弱酸,常温下pH=2的醋酸溶液,c(CH3COOH)>c(H+)=0.01mol/L,所以与等体积、pH=12的NaOH溶液混合后,电离的醋酸与NaOH恰好中和,由于醋酸过量,所得的溶液是醋酸与醋酸钠的混合溶液,醋酸电离产生CH3COO-,最终达到平衡时,溶液中c(Na+)<c(CH3COO-),D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是

A. 实验过程中①、⑤步骤的操作分别是溶解、过滤
B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+
C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
D. 实验过程中②、④步骤互换,对实验结果不影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1mol·L1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是

A. Mo2N/GCE电极为阴极
B. 溶液中H+通过隔膜向MoN/GCE电极区迁移
C. Mo2N/GCE电极区反应式为N2+6H++6e====2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:
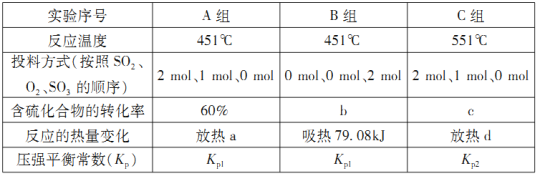
①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1___________Kp2(填“>”、“<”或“=”)。
③451℃,若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
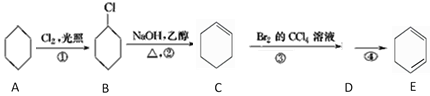
(1)A的名称是________________ ;B的分子式为______________。
(2)反应①的方程式为:________________;反应②为_______________反应;反应④的化学方程式是__________________。
(3)写出B在NaOH水溶液中加热的反应方程式:_____________,生成物官能团的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面)如图。对于该有机物的叙述正确的是
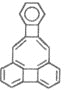
①该有机物属于芳香烃;②该有机物的分子式为C22H12; ③该有机物能发生加成反应;④该有机物的一氯代物的同分异构体有6种
A. ①③④B. ①②C. ②③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾是常见的氧化剂,用于制造火药、烟火。工业上用石灰乳氯化法制备氯酸钾的流程如图所示:
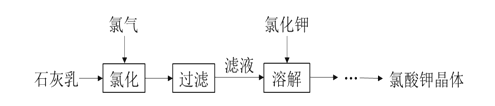
已知:氯化过程主要发生反应:![]()
完成下列填空:
(1)工业生产氯气的方法是________(请用文字表述)。
(2)氯化过程需要控制较高温度,其目的有:①_______;②减少Cl2与Ca(OH)2之间的副反应。
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应的化学方程式:______。得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是_______。
(4)为测定所得晶体中氯酸钾的纯度,将a g样品与b g二氧化锰混合,加热该混合物一段时间后(杂质不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如下表:
加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量(g) | c | d | e | e |
(i)进行加热操作时,应将固体置于________(填仪器名称)中。
(ii)该实验不必进行第五次加热的原因是_______。
(iii)若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
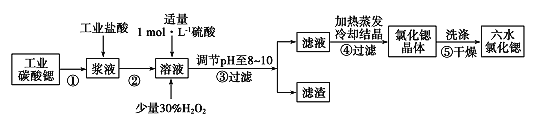
请回答:
(1)常温下,氯化锶溶液pH____7(已知金属性Ca<Sr)(填“大于”、“等于”或“小于”);
(2)写出在浆液中加入盐酸时主要发生的离子方程式________;
(3)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com