
【题目】室温下,![]() 的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
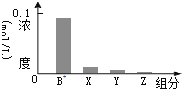
A.溶液显中性B.升温,![]() 增大,
增大,![]() 减小
减小
C.![]() D.稀释溶液,
D.稀释溶液,![]() 增大,
增大,![]() 增大
增大
【答案】C
【解析】
![]() 的一元碱BOH与等浓度的盐酸等体积混合后,
的一元碱BOH与等浓度的盐酸等体积混合后,![]() ,所得溶液中
,所得溶液中![]() 浓度小于
浓度小于![]() ,说明在溶液中存在
,说明在溶液中存在![]() ,BOH为弱碱,BCl溶液呈酸性,则
,BOH为弱碱,BCl溶液呈酸性,则![]() ,一般来说,盐类的水解程度较小,则:
,一般来说,盐类的水解程度较小,则:![]() ,反应后溶液中离子浓度大小为:
,反应后溶液中离子浓度大小为:![]() 即X表示
即X表示![]() ,Y表示BOH,Z表示
,Y表示BOH,Z表示![]() ,溶液中存在物料守恒为:
,溶液中存在物料守恒为:![]() ,据此解答。
,据此解答。
![]() 的一元碱BOH与等浓度的盐酸等体积混合后,
的一元碱BOH与等浓度的盐酸等体积混合后,![]() ,所得溶液中
,所得溶液中![]() 浓度小于
浓度小于![]() ,说明在溶液中存在
,说明在溶液中存在![]() ,BOH为弱碱,BCl溶液呈酸性,则
,BOH为弱碱,BCl溶液呈酸性,则![]() ,一般来说,盐类的水解程度较小,则:
,一般来说,盐类的水解程度较小,则:![]() ,反应后溶液中离子浓度大小为:
,反应后溶液中离子浓度大小为:![]() 即X表示
即X表示![]() ,Y表示BOH,Z表示
,Y表示BOH,Z表示![]() ,溶液中存在物料守恒为:
,溶液中存在物料守恒为:![]() ,
,
A.BOH为弱碱,反应生成强酸弱碱盐BCl,则溶液显酸性,故A错误;
B.盐的水解为吸热反应,升温促进水解,则Y浓度增大,故B错误;
C.X表示![]() ,Y表示BOH,Z表示
,Y表示BOH,Z表示![]() ,溶液中存在物料守恒为:
,溶液中存在物料守恒为:![]() ,故C正确;
,故C正确;
D.稀释后促进水解,但是溶液中氢离子浓度减小,即![]() 减小,故D错误;
减小,故D错误;
故答案选C。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g) ![]() nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
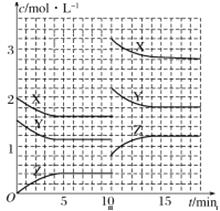
A.反应方程式中n=1
B.10min时,曲线发生变化的原因是升高温度
C.10min时,曲线发生变化的原因是增大压强
D.前5min后,用X表示的反应速率为v(X)=0.08mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种可充电锂电池,反应原理是4Li+FeS2 ![]() Fe+2Li2S,LiPF6 是电解质,SO(CH3 )2 是溶剂。下列说法正确的是( )
Fe+2Li2S,LiPF6 是电解质,SO(CH3 )2 是溶剂。下列说法正确的是( )

A. 放电时,a 极被还原
B. 放电时,电解质溶液中 PF6- 向 b 极区迁移
C. 充电时,b 极反应式为Fe+2Li2S-4e-=FeS2+4Li+
D. 充电时,a 极连接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ/mol
1molCO和3molCH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
A.2912kJB.2953kJC.3236kJD.3867kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二砷,俗称砒霜,分子式![]() ,是最古老的毒物之一,某含砷元素(
,是最古老的毒物之一,某含砷元素(![]() )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗![]() 。
。
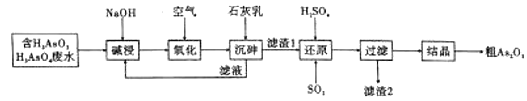
(1)“碱浸”时发生的反应有:![]() ;
;![]() 。其目的是将废水中的
。其目的是将废水中的![]() 和
和![]() 转化为盐,其中
转化为盐,其中![]() 的化学名称为___________________。
的化学名称为___________________。
(2)“通入空气氧化”时,![]() 转化为
转化为![]() 时反应转移的电子数为______NA。
时反应转移的电子数为______NA。
(3)“沉砷”是将元素转化为![]() 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
a.![]()
b.![]()
“沉砷”时加人少量稀盐酸,________(填“有利于”或“不利于”)砷元素转化为![]() 沉淀,简述原因:__________________________________。
沉淀,简述原因:__________________________________。
(4)“还原”过程中![]() 转化为
转化为![]() ,反应的化学方程式是_________________________。
,反应的化学方程式是_________________________。
(5)“还原”后过滤所得滤渣2为__________(填化学式),![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:_____________________________________。已知:
溶胶的化学方程式:_____________________________________。已知:![]() 对其聚沉能力较强,
对其聚沉能力较强,![]() 对其聚沉能力较弱,则
对其聚沉能力较弱,则![]() 胶粒带__________(填“正电荷”或“负电荷”)。
胶粒带__________(填“正电荷”或“负电荷”)。
(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入![]() 和稀
和稀![]() ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
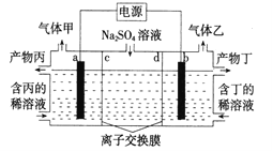
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,请回答:
(1)已知某温度时,醋酸的电离平衡常数Ka=1.6×10-5。
①醋酸的起始浓度为0.010mol/L,平衡时c(H+)=______(提示:醋酸的电离平衡常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L
②pH=1的醋酸与pH=l的盐酸等体积混合,混合后溶液中c(CH3COO-)=_______。
(2)日常生活中常用醋酸除水垢,但工业锅炉的水垢中常含有CaSO4,需先用________(填化学式)溶液处理,而后用盐酸去除。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.向NaHCO3溶液中加入足量的Ba(OH)2:2HCO3-+Ba2++2OH-=BaCO3↓+ CO32-+2H2O
B.向亚硫酸钠溶液中滴入少量新制的氯水:3SO32-+ Cl2+H2O= SO42-+2Cl-+2HSO3-
C.电解KI溶液阴极电极反应2H2O-4e-= O2↑+4H+
D.Fe2O3固体投入到少量HI溶液中:Fe2O3+6H++6I-=2Fe2++3I2+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com