
【题目】三氧化二砷,俗称砒霜,分子式![]() ,是最古老的毒物之一,某含砷元素(
,是最古老的毒物之一,某含砷元素(![]() )的工业废水经如图所示流程转化为粗
)的工业废水经如图所示流程转化为粗![]() 。
。
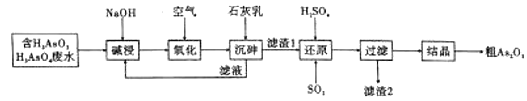
(1)“碱浸”时发生的反应有:![]() ;
;![]() 。其目的是将废水中的
。其目的是将废水中的![]() 和
和![]() 转化为盐,其中
转化为盐,其中![]() 的化学名称为___________________。
的化学名称为___________________。
(2)“通入空气氧化”时,![]() 转化为
转化为![]() 时反应转移的电子数为______NA。
时反应转移的电子数为______NA。
(3)“沉砷”是将元素转化为![]() 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
a.![]()
b.![]()
“沉砷”时加人少量稀盐酸,________(填“有利于”或“不利于”)砷元素转化为![]() 沉淀,简述原因:__________________________________。
沉淀,简述原因:__________________________________。
(4)“还原”过程中![]() 转化为
转化为![]() ,反应的化学方程式是_________________________。
,反应的化学方程式是_________________________。
(5)“还原”后过滤所得滤渣2为__________(填化学式),![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:_____________________________________。已知:
溶胶的化学方程式:_____________________________________。已知:![]() 对其聚沉能力较强,
对其聚沉能力较强,![]() 对其聚沉能力较弱,则
对其聚沉能力较弱,则![]() 胶粒带__________(填“正电荷”或“负电荷”)。
胶粒带__________(填“正电荷”或“负电荷”)。
(6)确定物质中是否含有砒霜,常用马氏试砷法。其原理是在含砒霜的物质中加入![]() 和稀
和稀![]() ,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
,得到一种气体A。加热A,在试管中得到砷镜。写出生成A的离子方程式:____________________。
【答案】亚砷酸 4 有利于 加入少量稀盐酸对于a平衡![]() 减小,平衡a正向移动,
减小,平衡a正向移动,![]() 增加,可以使b平衡向正反应方向移动,有利于“沉砷”
增加,可以使b平衡向正反应方向移动,有利于“沉砷” ![]()
![]()
![]() 负电荷
负电荷 ![]()
【解析】
向工业废水(含有H3AsO4、H3AsO3)加入氢氧化钠碱浸:H3AsO4+3NaOH═Na3AsO4+3H2O、H3AsO3+3NaOH═Na3AsO3+3H2O,得到含有Na3AsO4、Na3AsO3的溶液,融入氧气氧化Na3AsO3为Na3AsO4,再加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,反应为:H3AsO4+H2O+SO2═H3AsO3+H2SO4,“还原”后加热溶液,H3AsO3分解为As2O3,调硫酸浓度约为7molL-1,冷却至25℃,过滤,得粗As2O3,据此分析作答。
(1) As元素与N元素同族,![]() 中As元素的化合价为+4价,不是最高价,则
中As元素的化合价为+4价,不是最高价,则![]() 为亚砷酸;
为亚砷酸;
(2) “通入空气氧化”时,![]() 转化为
转化为![]() 时As元素由+4价变为+6价,反应转移的电子数为2mol×2×NA=4 NA;
时As元素由+4价变为+6价,反应转移的电子数为2mol×2×NA=4 NA;
(3)加入少量稀盐酸对于a平衡![]() 减小,
减小,![]() 增加,可以使b平衡向正反应方向移动,有利于“沉砷”;
增加,可以使b平衡向正反应方向移动,有利于“沉砷”;
(4)根据分析,“还原”过程中![]() 和二氧化硫反应转化为
和二氧化硫反应转化为![]() ,反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;
,反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;
(5)根据分析,“还原”后过滤所得滤渣2为硫酸钙;![]() 在低温下微溶于水,加热溶于水后生成
在低温下微溶于水,加热溶于水后生成![]() 溶液,将硫化氢气体通入
溶液,将硫化氢气体通入![]() ,溶液中制备
,溶液中制备![]() 溶胶,写出制取
溶胶,写出制取![]() 溶胶的化学方程式:
溶胶的化学方程式:![]() ;
;![]() 和
和![]() 中都含有氯离子,但钙离子比钠离子电荷多,说明
中都含有氯离子,但钙离子比钠离子电荷多,说明![]() 胶粒带负电荷;
胶粒带负电荷;
(6)砒霜的主要成分为氧化砷,向其中加入![]() 和稀
和稀![]() 反应生成硫酸锌和砷化氢,离子方程式为:
反应生成硫酸锌和砷化氢,离子方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.明矾溶液中加入过量的氨水 Al3++4OH-=AlO2-+2H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HClO+CO32-
C.用石墨作电极电解饱和食盐水: ![]()
D.澄清的石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() 的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
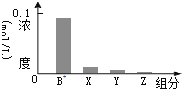
A.溶液显中性B.升温,![]() 增大,
增大,![]() 减小
减小
C.![]() D.稀释溶液,
D.稀释溶液,![]() 增大,
增大,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】画出CH3﹣C≡C﹣CH=CH2分子的立体结构式____________,分析该分子式中有_____个碳原子共线,_____碳原子共面,最少有_____个原子共面,最多有_____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com