
【题目】电解装置如图所示:
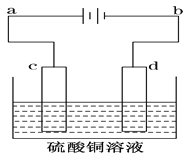
Ⅰ.当用惰性电极电解时,c为____________极,电极反应________d为____________极,电极反应______________,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________(填铁或铜)d为___________(填铁或铜)电解液浓度_____________(增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______(填离子符号)形式进入溶液,c电极发生的反应______________,________________
【答案】I.阳极 4OH--4e-===O2↑+2H2O或2H2O-4e-=4H++O2↑
阴极:2Cu2++4e-===2Cu 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
Ⅱ.(1)铜 铁 不变 (2)0.25
Ⅲ.c Fe2+ Cu-2e-===Cu2+ Fe -2e-=== Fe2+
【解析】
试题分析:I.根据电解装置图可知,当用惰性电极电解时,c与电源的正极相连,则c为阳极,溶液中的OH-在阳极放电生成氧气,电极反应为4OH--4e-===O2↑+2H2O;d与电源的负极相连,则d为阴极,溶液中的铜离子在阴极放电生成铜,电极反应为2Cu2++4e-===2Cu;阴极、阳极电极反应相加得到电池的总反应,则电解总反应的化学方程为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
Ⅱ.(1)要实现在铁制品上镀铜,铁制品需作阴极,镀层铜作阳极,含镀层金属阳离子的盐溶液作电解质溶液,所以c为铜,d为铁,阳极铜放电,阴极溶液中的铜离子放电,则电解液浓度不变。
(2)根据阳极:Cu-2e→Cu2+、阴极:Cu2++2e→Cu 两极质量差为128,当两极质量差为16克,说明转移的电子为16÷128×2=0.25mol.
Ⅲ. 电解精炼时,粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液,比铜活泼的金属失电子生成离子进入溶液,不如铜活泼的金属形成阳极泥沉积下来,所以粗铜板是图中电极c;若粗铜中还含有Au、Ag、Fe,铁比铜活泼,则Fe以Fe2+形式进入溶液,c电极发生的反应Cu-2e-===Cu2+ 、Fe -2e-=== Fe2+。


科目:高中化学 来源: 题型:
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
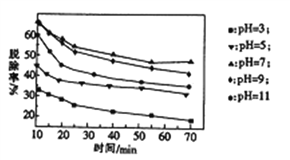
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
(2)脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是___________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇和浓硫酸制取乙烯,其反应式为CH3CH2OH![]() CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
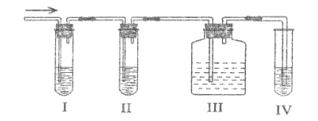
I、II、III、IV装置可以盛放的试剂有:
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液(试剂可以重复使用)
(1)I、II、III、IV装置中所盛的试剂分别为:_________、_________、_________、_________(填序号)
(2)使用装置II的目的是_________________。
(3)确定含有乙烯的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
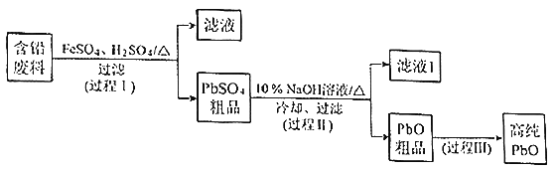
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
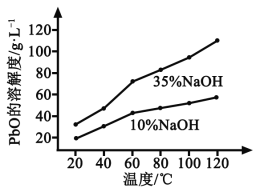
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将23 g Na、18 g Al、56 g Fe分别投入盛有200 g 7.3%的盐酸中,结果正确的是( )
A. 反应结束时产生的气体一样多
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,产生的气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。下图是合成具有特殊功能高分子材料W(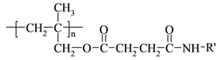 )的流程:
)的流程:
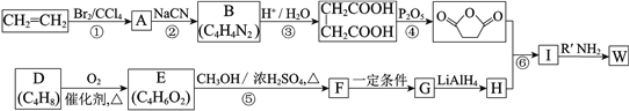
已知:(R、R1、R2代表烃基)
I、![]()
![]() RCH2OH
RCH2OH
II、![]()
⑴反应①的反应类型是_______________。
⑵反应②是取代反应,其化学方程式是___________________________________________。
⑶D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是______。
⑷反应⑤的化学方程式是__________________________________________________。
⑸G的结构简式是__________________。
⑹反应⑥的化学方程式是__________________________________________________。
⑺工业上也可用![]() 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件, 不易发生取代反应)__________________
不易发生取代反应)__________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
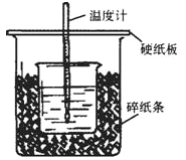
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________________
(2)在测定中和热的实验中,计算反应热时需要的数据有________________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),所放出的热量____ (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_____(填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能
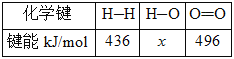
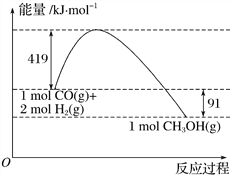
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质发生反应生成的气体分别通入FeCl2溶液,不能与FeCl2发生反应的是
A. CaO和浓氨水 B. 二氧化锰和浓盐酸共热
C. Na2O2和CO2 D. 铜片和浓硫酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列有关NH4HCO3和HCl反应的说法正确的是
A.NH4HCO3和HCl的反应是放热反应
B.NH4HCO3和HCl的反应是吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com