
【题目】将23 g Na、18 g Al、56 g Fe分别投入盛有200 g 7.3%的盐酸中,结果正确的是( )
A. 反应结束时产生的气体一样多
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,产生的气体最多
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为: .
(2)该反应的正反应为 反应(“吸热”或“放热”).
(3)能判断该反应是否已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A. 第一块钠失去电子多 B. 两块钠的反应产物质量一样大
C. 第二块钠的反应产物质量大 D. 两块钠失去电子一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示:
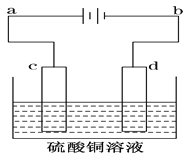
Ⅰ.当用惰性电极电解时,c为____________极,电极反应________d为____________极,电极反应______________,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________(填铁或铜)d为___________(填铁或铜)电解液浓度_____________(增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______(填离子符号)形式进入溶液,c电极发生的反应______________,________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
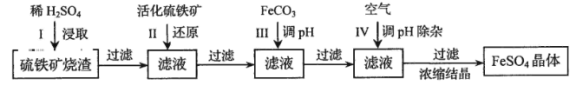
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) ![]() =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) ![]() =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ![]() =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=________
CO2(g)+H2(g)的平衡常数K2=________
(3)已知在1000 ℃时,该反应的平衡常数K3=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,从开始到20s时反应达到平衡状态,则CO浓度为____________mol/L,CO2的转化率为____________。此温度下,若某时刻CO2的物质的量为2 mol,则此时v正______________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一体积不变的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),能说明该反应达到化学平衡状态的是
2NH3(g),能说明该反应达到化学平衡状态的是
A. N2、H2、NH3的浓度相等
B. 容器内压强不再变化
C. 单位时间内消耗a mol N2,同时生成2a mol NH3
D. 容器内混合气体密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com