
【题目】一定条件下,在一体积不变的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),能说明该反应达到化学平衡状态的是
2NH3(g),能说明该反应达到化学平衡状态的是
A. N2、H2、NH3的浓度相等
B. 容器内压强不再变化
C. 单位时间内消耗a mol N2,同时生成2a mol NH3
D. 容器内混合气体密度不再变化
科目:高中化学 来源: 题型:
【题目】将23 g Na、18 g Al、56 g Fe分别投入盛有200 g 7.3%的盐酸中,结果正确的是( )
A. 反应结束时产生的气体一样多
B. Al和盐酸的反应速率仅次于钠,但产生的气体最多
C. 铁和盐酸反应产生的气体比Na产生的多
D. Na和盐酸反应最剧烈,产生的气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() 的叙述错误的是
的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Mg、Al三种金属各2mol分别跟1L 1molL﹣1的盐酸反应时,相同条件下放出氢气体积最大的是( )
A.Al
B.Mg
C.Na
D.三者产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。下列有关NH4HCO3和HCl反应的说法正确的是
A.NH4HCO3和HCl的反应是放热反应
B.NH4HCO3和HCl的反应是吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60[ |
4 | 820℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
根据上述实验数据,完成下列填空:
(1)在实验1中,反应在10至20min时间内,反应物A的平均速率为 mol/(L·min)。
(2)在实验2中,A的初始浓度C2= mol/L,反应经20minA的浓度就不再发生变化,进而可推测实验2中隐含的条件是 。
(3)在实验3中,A的初始浓度C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____________反应(选填“吸热”、“放热”)。理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
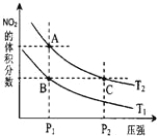
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图,下列说法正确的是( )
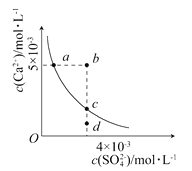
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com