
【题目】某化学反应2A(g)![]() B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60[ |
4 | 820℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
根据上述实验数据,完成下列填空:
(1)在实验1中,反应在10至20min时间内,反应物A的平均速率为 mol/(L·min)。
(2)在实验2中,A的初始浓度C2= mol/L,反应经20minA的浓度就不再发生变化,进而可推测实验2中隐含的条件是 。
(3)在实验3中,A的初始浓度C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____________反应(选填“吸热”、“放热”)。理由是_________________________。
【答案】
(1)0.013
(2)1.0 加入了催化剂
(3)>
(4)吸热 温度升高,A的平衡浓度减小,说明平衡正向移动,则正向为吸热反应
【解析】
试题分析:
(1)在实验1,反应在10至20分钟时间内A的浓度减少0.80-0.67=0.13mol/L,所以A的平均反应速率为0.13mol/L÷20min=0.0165 mol/(L·min);
(2)该反应是反应前后物质的量不变的可逆反应,温度不变时实验2与实验1达到平衡状态时A的浓度相同,且达到平衡的时间缩短,所以实验2与实验1是等效平衡,实验2使用了催化剂,A的起始浓度与实验1相同,所以C2=1.0mol/L;
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,由于实验3的温度与实验1相同,而平衡时的浓度3的高,而且在开始10min内高,开始物质的浓度实验3的高,说明在反应开始时C3>1.0mol/L;
(4)比较实验4和实验1,由于实验4的温度高于实验1,而开始时的物质浓度相同,达到平衡时的浓度实验1高,说明升高温度,平衡向正反应方向移动,由于升高温度,平衡向吸热反应方向移动,所以正反应方向是吸热反应。


科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
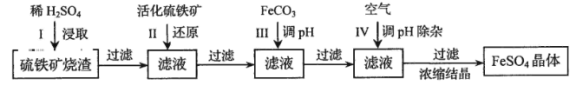
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) ![]() =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) ![]() =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ![]() =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一体积不变的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),能说明该反应达到化学平衡状态的是
2NH3(g),能说明该反应达到化学平衡状态的是
A. N2、H2、NH3的浓度相等
B. 容器内压强不再变化
C. 单位时间内消耗a mol N2,同时生成2a mol NH3
D. 容器内混合气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别食盐水和蔗糖水的方法有:①在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,微热;②测量溶液的导电性;③将溶液与溴水混合、振荡;④观察溶液颜色。其中在实验室进行鉴别的正确方法是
A. ①② B. ①③ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原电池的正极材料必须是金属
B.原电池的负极发生还原反应
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.原电池可以把物质内部的能量全部转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年的诺贝尔化学奖授予以色列科学家阿龙·切哈诺夫、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节蛋白质水解。关于蛋白质的组成与性质的叙述正确的是
A. 蛋白质在酶的作用下水解的最终产物为氨基酸
B. 向蛋白质溶液中加入Na2SO4浓溶液,会使其变性
C. 天然蛋白质仅由碳、氢、氧、氮四种元素组成
D. 氨基酸和蛋白质都是只能和碱反应的酸性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
B. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
C. 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA
D. C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染问题越来越受到人们的关注,造成环境污染的主要原因是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A. 温室效应——CO2 B. 光化学污染——NO2
C. 酸雨——SO2 D. 臭氧层破坏——CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com