
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。
【答案】(1)第三周期,ⅦA族
(2)Si
(3)ac
(4)Si(s)+2Cl2(g)=SiCl4(l) △H=687kJ/mol
(5)![]() ;Mg2C3+4H2O=2Mg(OH)2+ CH≡CHH3↑
;Mg2C3+4H2O=2Mg(OH)2+ CH≡CHH3↑
(6)NO 0.9mol;NO21.3mol;2mol
【解析】试题分析:(1)周期表中Z元素为氯元素,核电荷数为17,三个电子层,最外层7个电子,位于周期表中第三周期,第ⅤⅡA族。
(2)表中元素为第二周期和三周期中的元素,依据同周期原子半径依次减小,同主族原子半径依次增大分析可知,元素的原子半径最大的是Si。
(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明Y元素的非金属性比S元素的非金属性强,故a正确;b.在氧化还原反应中,氧化性强弱取决于得电子的难易,与得失电子数没有必然关系,故b错误;c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的非金属性较强,故c正确。
(4)依据题意可知,X(Si)与Z(Cl)两元素的单质反应生成1molX的最高价化合物SiCl4放热687KJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,且该烃分子中碳氢质量比为9:1,则该烃的分子式为C3H4,结构简式为:CH≡CHH3,则烃的电子式为![]() ;依据原子守恒和反应实质分析Q的化学式为Mg2C3,Q与水反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+CH≡CHH3↑。
;依据原子守恒和反应实质分析Q的化学式为Mg2C3,Q与水反应的化学方程式为:Mg2C3+4H2O=2Mg(OH)2+CH≡CHH3↑。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体为NO、NO2,最终转化为NaNO3,1mol氧气参与反应转移电子的物质的量为4mol,设出NO、NO2的物质的量分别为xmol、ymol,则:①x+y=2.2,②x+3y=4
解①②联立方程组得:x=1.3,y=0.9,
根据电子守恒:n(CuSO4)=4mol/2=2mol。
故答案为:NO 0.9mol,NO21.3mol;2mol。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为: .
(2)该反应的正反应为 反应(“吸热”或“放热”).
(3)能判断该反应是否已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=________
CO2(g)+H2(g)的平衡常数K2=________
(3)已知在1000 ℃时,该反应的平衡常数K3=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,从开始到20s时反应达到平衡状态,则CO浓度为____________mol/L,CO2的转化率为____________。此温度下,若某时刻CO2的物质的量为2 mol,则此时v正______________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
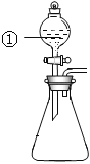
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水

已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一体积不变的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),能说明该反应达到化学平衡状态的是
2NH3(g),能说明该反应达到化学平衡状态的是
A. N2、H2、NH3的浓度相等
B. 容器内压强不再变化
C. 单位时间内消耗a mol N2,同时生成2a mol NH3
D. 容器内混合气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原电池的正极材料必须是金属
B.原电池的负极发生还原反应
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.原电池可以把物质内部的能量全部转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol ·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol ·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol ·L-1
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com