
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol ·L-1,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol ·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol ·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol ·L-1
A. ①③ B. ①④ C. ②③ D. ③④
【答案】B
【解析】试题分析:将4 mol A气体和2 mol B气体在2 L的容器中混合在一定条件下发生如下反应:2A(g)+B(g)=2C(g)。若经2s后,测得C的浓度为 0.6 mol·L-1,依据化学平衡三段式列式计算
2A(g)+B(g)![]() 2C(g)
2C(g)
开始物质的量(mol) 4 2 0
转化的物质的量(mol) 1.2 0.6 2L×0.6 mol·L-1
2s末的物质的量(mol) 2.8 2.8 1.2
① 用物质 A 表示的反应的平均速率为 1.2mol/2L/2s="0.3" mol·L-1·s-1 ,①正确;② 用物质 B表示的反应的平均速率为 0.15 mol·L-1·s-1 ,②错误;③ 2 s 时物质 A 的转化率为1.2/4×100%=30%,③错误;④ 2 s 时物质 B 的浓度为 (2-0.6)mol/2L="0.7" mol·L-1 , ④正确,正确的有①④,答案为B。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
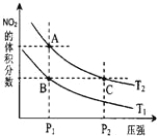
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火烧圆明园时流失了大量的国宝,如:铜铸的鼠首和兔首。普通铜器时间稍久容易出现铜绿,其主要成分是〔Cu2(OH)2CO3〕,这两件1760年铜铸的国宝在240多年后看上去仍然熠熠生辉不生锈,下列对其原因的分析最可能的是:
A. 它们的表面都电镀上了一层耐腐蚀的黄金
B. 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C. 铜的金属活动性比氢小,因此不易被氧化
D. 它是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。若以HA表示酸,下列说法正确的是( )
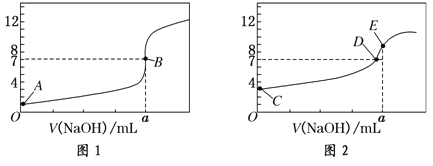
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+) = c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A—) >c(Na+)> c(H+) > c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图,下列说法正确的是( )
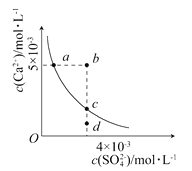
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,由蛇纹石制取碱式碳酸镁的实验步骤如下:
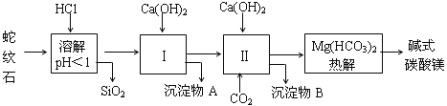
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是 。
(2)进行Ⅰ操作时,控制溶液的pH=7~8(有关氢氧化物沉淀的pH见下表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解,产生 沉淀。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)从沉淀混合物A中提取红色氧化物作为颜料,先向沉淀物A中加入 (填加入物质的化学式),然后 (依此填写实验操作名称)。物质循环使用,能节约资源。上述实验中,可以循环使用的物质是 (填写物质的化学式)。
(4)现设计实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值。请写出下列实验步骤中所需要测定的项目(可用试剂:浓硫酸、碱石灰、氢氧化钠溶液、澄清石灰水):①样品称量,②高温分解,③ ,④ ,⑤MgO称量。
(5)从下列仪器(装有必要的试剂)中选择完成上述实验所必需的仪器,连接一套装置 (选择仪器代号,可重复使用,用“A→B→……→”表示)
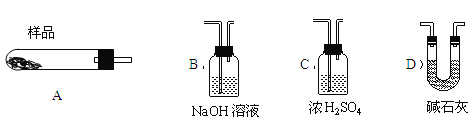
(6)18.2g产品完全分解后,产生6.6gCO2和8.0gMgO,由此可知,产品的化学式中a= ,b= ,c= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com