
【题目】将下列各组物质发生反应生成的气体分别通入FeCl2溶液,不能与FeCl2发生反应的是
A. CaO和浓氨水 B. 二氧化锰和浓盐酸共热
C. Na2O2和CO2 D. 铜片和浓硫酸共热
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。
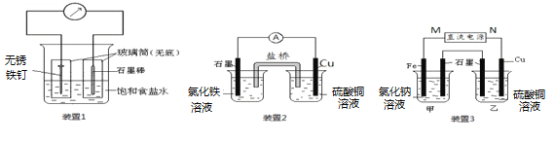
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为_________________。
(2)装置2中的石墨是极________(填“正”或“负”),该装置发生的总反应的离子方程式为________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
① 电源的M端为极____________(填“正”或“负”),甲烧杯中铁电极的电极反应为__________。
② 乙烧杯中电解反应的化学方程式为___________________________。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示:
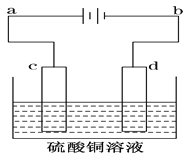
Ⅰ.当用惰性电极电解时,c为____________极,电极反应________d为____________极,电极反应______________,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________(填铁或铜)d为___________(填铁或铜)电解液浓度_____________(增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________(填图中的字母);若粗铜中还含有Au、Ag、Fe,则Fe以_______(填离子符号)形式进入溶液,c电极发生的反应______________,________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+(2)Fe+Cu2+=Fe2++Cu。判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是
A. Fe3+>Cu2+>Fe2+
B. Cu2+>Fe3+>Fe2+
C. Fe3+Fe2+>Cu2+
D. Fe2+>Cu2+>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=________
CO2(g)+H2(g)的平衡常数K2=________
(3)已知在1000 ℃时,该反应的平衡常数K3=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,从开始到20s时反应达到平衡状态,则CO浓度为____________mol/L,CO2的转化率为____________。此温度下,若某时刻CO2的物质的量为2 mol,则此时v正______________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用无机矿物资源生产部分材料。下列有关说法不正确的是
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D.黄铜矿(CuFeS2)冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
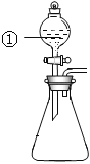
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水

已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
C.稀醋酸中加入少量NaOH固体,溶液的导电性增强
D.向醋酸中加入氨水至中性,溶液中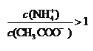
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com