已知化学反应①:Fe(s)+CO
2(g)=FeO(s)+CO(g),其平衡常数为K
1;
化学反应②:Fe(s)+H
2O(g)=FeO(s)+H
2(g),其平衡常数为K
2.
在温度973K和1173K情况下,K1、K
2的值分别如下:
| 温度 |
K1 |
K2 |
| 973K |
1.47 |
2.38 |
| 1173K |
2.15 |
1.67 |
(1)现有反应③:CO
2(g)+H
2(g)=CO(g)+H
2O(g),平衡常数为K
3①请根据反应①与②可推导出K
1、K
2与K
3之间的关系式为
.据此关系式及上表数据,也能推断出反应③是
(填“吸热”或“放热”)反应.
②图甲、乙分别表示反应③在t
1时刻达到平衡、在t
2时刻因改变某个条件而发生变化的情况
i图甲中t
2时刻发生改变的条件是
(答出所有可能情况).
ii图乙中t
2时刻发生改变的条件是
(答出所有可能情况).
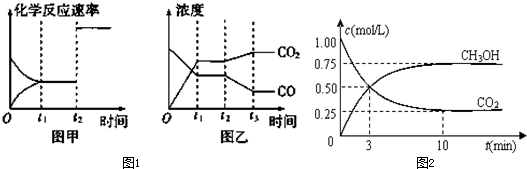
(2)在容积为1L的密闭容器中,充入1mol CO
2和3mol H
2,在500℃下发生反应.
CO
2(g)+3H
2(g)
CH
3OH(g)+H
2O(g)△H=-49.47kJ/mol
有关物质的浓度随时间变化如图所示.
①从反应开始到平衡,H
2的平均反应速率v(H
2)=
.
②若其它条件不变,只将温度提高到800℃,再次达平衡时,n(CH
3OH)/n(CO
2)比值
(填“增大”、“减小”或“不变”).
(3)上述反应中的氢气还可用于工业上合成氨气.请回答下列问题:
在25℃下,将a mol?L
-1的氨水与0.01mol?L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
4+)=c(Cl
-),用含a的代数式表示NH
3?H
2O的电离常数K
b=
.





 利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.
利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.