
����Ŀ��ijѧϰС���о���Һ��Fe2+���ȶ��ԣ���������ʵ�飬�۲죬��¼�����

ʵ���
���� | 0 min | 1min | 1h | 5h |
FeSO4 | ����ɫ | �ۺ�ɫ | ��ɫ | ���ɫ |
(NH4)2Fe(SO4)2 | ������ɫ | ����ɫ | ��ɫ | �ۺ�ɫ |
��1������(NH4)2Fe(SO4)2��ҺpHС��FeSO4��ԭ����_______���û�ѧ�����ʾ������Һ���ȶ��ԣ�FeSO4_______(NH4)2Fe(SO4)2������������� ��
��2����ͬѧ���ʵ���������Һ���ȶ��Բ��������(NH4)2Fe(SO4)2��Һ�е�NH4+������Fe2+����ΪNH4+���л�ԭ�ԡ�����ʵ����˸ù۵㣬��ȫ��ʵ�顣
���� | ���� |
ȡ_______����_______���۲졣 | ��ʵ�����(NH4)2Fe(SO4)2��Һ������ͬ�� |
��3����ͬѧ���ʵ���������Һ���ȶ��Բ�������Һ���Բ�ͬ���£�����ʵ��ֱ�����0.80 mol��L��1 pHΪ1��2��3��4��FeSO4��Һ���۲죬����pH��1��FeSO4��Һ��ʱ�������Ա仯��pHԽ��FeSO4��Һ��Ƶ�ʱ��Խ�̡�
������ʾ����������Һ�д��ڷ�Ӧ 4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+
4Fe(OH)3��8H+
��ʵ��III����ͬѧ�ɵó��Ľ�����_______��ԭ����_______��
��4����һ���о���ˮ��Һ��Fe2+�������������ⶨͬŨ��FeSO4��Һ�ڲ�ͬpH�����£�Fe2+������������ʱ��Ĺ�ϵ��ͼ��ʵ���������Һ�¶ȼ����ޱ仯������Ӧ���ڣ��������ʶ��������ԭ�������_____��

��5���ۺ�����ʵ�飬��ǿFe2+�ȶ��ԵĴ�ʩ��_______��
���𰸡�NH4+��H2O![]() NH3��H2O��H+ �� ȡ2 mL pH��4.0��0.80 mol��L��1 FeSO4��Һ ��2��0.01 mol��L��1 KSCN��Һ ��ҺpHԽС��Fe2+Խ�ȶ� ��Һ�д���ƽ��4Fe2+��O2��10H2O
NH3��H2O��H+ �� ȡ2 mL pH��4.0��0.80 mol��L��1 FeSO4��Һ ��2��0.01 mol��L��1 KSCN��Һ ��ҺpHԽС��Fe2+Խ�ȶ� ��Һ�д���ƽ��4Fe2+��O2��10H2O ![]() 4Fe(OH)3��8H+�� c��H+����ƽ�����������ǿ��Fe2+���ȶ� ���ɵ�Fe(OH)3�Է�Ӧ�д����� ��һ��������ܷⱣ��
4Fe(OH)3��8H+�� c��H+����ƽ�����������ǿ��Fe2+���ȶ� ���ɵ�Fe(OH)3�Է�Ӧ�д����� ��һ��������ܷⱣ��
��������
��1����NH4��2Fe��SO4��2��Һ��FeSO4�е�Fe2+Ũ����ͬ�����У�NH4��2Fe��SO4��2����Ũ�Ƚϸߵ�NH4+��ͨ�������е���ɫ�仯��������
��2��������Ҫ��֤����Һ���ȶ��Բ����Ƿ������ڣ�NH4��2Fe��SO4��2��Һ�е�NH4+������Fe2+���£����ݿ��Ʊ�������֪��Ӧ������NH4+���Ӱ�������������Ӱ�����ؾ�����һ�£��ݴ˷�����
��3����ʵ����֪����Һ��pHԽС����Һ������Խǿ����Fe2+Խ�ȶ�����������Һ�д��ڷ�Ӧ4Fe2++O2+10H2O4Fe��OH��3+8H+������ƽ����ƶ���������
��4������Ӱ�췴Ӧ���ʵ�������Ũ�ȡ�ѹǿ���¶Ⱥʹ�����������
��5����������ʵ����������
��1����NH4��2Fe��SO4��2��Һ��FeSO4�е�Fe2+Ũ����ͬ������NH4��2Fe��SO4��2��Һ�к���Ũ�Ƚϸߵ�NH4+��NH4+ˮ�������ԣ����£�NH4��2Fe��SO4��2�е�pH��С��ͨ�������е���ɫ�仯��֪��NH4��2Fe��SO4��2�е�Fe2+�����������ʸ���������Һ���ȶ��ԣ�FeSO4<��NH4��2Fe��SO4��2���ʴ�Ϊ��NH4++H2O![]() NH3H2O+H+��<��
NH3H2O+H+��<��
��2��������Ҫ��֤����Һ���ȶ��Բ����Ƿ������ڣ�NH4��2Fe��SO4��2��Һ�е�NH4+������Fe2+���£����ݿ��Ʊ�������֪��Ӧ������NH4+���Ӱ�������������Ӱ�����ؾ�����һ�£���Ӧȡ2mLpH=4.0��0.80molL-1FeSO4��Һ���Թ��У���2��0.01molL-1KSCN��Һ�������۲쵽��������ʵ����У�NH4��2Fe��SO4��2��Һ������ͬ����˵���������벻��ȷ���ʴ�Ϊ��ȡ2mLpH=4.0��0.80molL-1FeSO4��Һ����2��0.01molL-1KSCN��Һ��
��3����ʵ����֪����Һ��pHԽС����Һ������Խǿ����Fe2+Խ�ȶ�����������Һ�д��ڷ�Ӧ4Fe2++O2+10H2O![]() 4Fe��OH��3+8H+����Һ��pHԽС����������Ũ��Խ��ƽ�����ƣ���Fe2+�����������ƣ��ʴ�Ϊ����ҺpHԽС��Fe2+Խ�ȶ�����Һ�д���ƽ��4Fe2++O2+10H2O
4Fe��OH��3+8H+����Һ��pHԽС����������Ũ��Խ��ƽ�����ƣ���Fe2+�����������ƣ��ʴ�Ϊ����ҺpHԽС��Fe2+Խ�ȶ�����Һ�д���ƽ��4Fe2++O2+10H2O![]() 4Fe��OH��3+8H+��c��H+����ƽ�����������ǿ��Fe2+���ȶ���
4Fe��OH��3+8H+��c��H+����ƽ�����������ǿ��Fe2+���ȶ���
��4��Ӱ�췴Ӧ���ʵ�������Ũ�ȡ�ѹǿ���¶Ⱥʹ�������ͬһ�������ϵ�Ũ��FeSO4��Һ��ͬ����Ӧ���ŷ�Ӧ�Ľ��У�Fe2+��Ũ�ȼ�С���ʲ���Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻���˷�ӦΪ��Һ�еķ�Ӧ����ѹǿ�Դ˷�Ӧ������Ӱ�죻���˷�Ӧ���¶Ȳ��䣬����Ӱ�췴Ӧ���ʵ�ֻ�д�������Ψһ�Ŀ���ԭ�������ɵ�Fe��OH��3�Է�Ӧ�д����ã��ʴ�Ϊ�����ɵ�Fe��OH��3�Է�Ӧ�д����ã�
��5����������ʵ���֪������һ�������������Fe2+�����������Ǹ��������ܷⱣ�棬�ʴ�Ϊ������һ�������ᣬ�ܷⱣ�档


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(BN)�����ж�����ṹ�������൪������ͨ�����ڵ��ȶ��࣬��ʯī���ƣ����в�״�ṹ�������������������൪�����dz�Ӳ���ϣ����������ĥ�ԡ����ǵľ���ṹ����ͼ��ʾ��
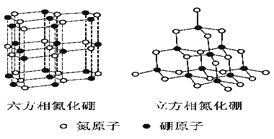
����̬��ԭ�ӵĵ����Ų�ʽΪ______________________________��
�� ���������־����˵������ȷ����_________________(�����)��
a.�����൪����������������������Ӳ�ȴ� b.�����൪������������С�������ʵ���
c.���־����е�B��N����Ϊ���ۼ� d.���־����Ϊ���Ӿ���
�������൪���������һ����ԭ�������ڵ�ԭ�ӹ��ɵĿռ乹��Ϊ________����ṹ��ʯī����ȴ�����磬ԭ����______________________________��
�������൪�������У���ԭ�ӵ��ӻ��������Ϊ___________________���þ������Ȼ��������ظ�ԭ����Լ300Km�Ĺŵؿ��б����֡�������һ�����γ���ʵ���ƶ�ʵ�����������൪����ϳ������൪������Ҫ������Ӧ��____________________________��
��NH4BF4(�������)�Ǻϳɵ��������ܵ�ԭ��֮һ��1mo NH4BF4����_____________mol��λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ�Ƕ�����������Ϊ��������Ե�ʡ�ij�о�С��Ϊ�о���Һ��Fe2+��O2�����Ĺ��̣��������Ϸ��֣���Һ��Fe2+���������̷�Ϊ�Ⱥ�������������Fe2+ˮ�⣬����ˮ����ﱻO2����������С��ͬѧ�����о������²�ͬpH��Fe2+��O2������Ӱ�죬���ⶨ��Fe2+��������ʱ��仯�Ĺ�ϵ�������ͼ���ش��������⣺
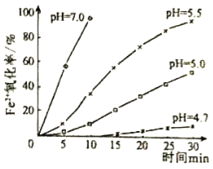
��1��д��Fe2+ˮ������ӷ���ʽ______��Ҫ����FeSO4ˮ�⣬���Բ�ȡ�Ĵ�ʩ��______��
��2�������������£�Fe2+��O2�����ķ�Ӧ����ʽΪ��4Fe2++O24Fe3++2H2O����֪�����¸÷�Ӧ��ƽ�ⳣ���ܴ�������˵����ȷ����______��
a��Fe2+ת��ΪFe3+�����ƺܴ� b��Fe2+ת��ΪFe3+�����ʺܴ�
c���÷�Ӧ���еú���ȫ d������������Fe2+���ᱻ����
��3�������ͼ������ͬpH��Fe2+��O2�����ķ�Ӧ������������Ӱ��______��
��4���о�С���ڲ�������ʱ����֪������������������Һ��������ǿ����ǿ��ͨ�������о���֪������FeSO4��Һ����ȷ������______��
��5����K2Cr2O7����Һ�ⶨ��Һ��Fe2+Ũ�ȣ��Ӷ�����Fe2+�������ʡ���Ӧ���£�6Fe2++Cr2O72-+14H+��2Cr3++6Fe3++7H2O��ȡ20mL������Һ����0.0200molL-1KCr2O7����Һ�ζ������ı���Һ16.50mL������Һ��c��Fe2+��=______molL-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����Ԫ���ǹ������������ҪԪ�أ��ڶ�ֲ���������������Ҫ���á�����Ҫ��ش��������⣺
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________�����������ڻ�̬14Cԭ���У��������____________������״̬�෴�ĵ��ӡ�
��2����֪��(NH4)2CO3![]() 2NH3��+H2O��+CO2��
2NH3��+H2O��+CO2��
������ͬ���ڣ��ҵ�һ�����ܱ������Ԫ����____________�֡�
��(NH4)2CO3�ֽ����õ���̬��������ӵļ�����С�����˳��Ϊ____________���ѧʽ����
��3������ ��Cԭ���ӻ���ʽ��____________��
��Cԭ���ӻ���ʽ��____________��
��4�������[Cu(CH3C![]() N)4]BF4�У�ͭԭ�ӵļ۵��Ӳ�ʽΪ____________��BF4-�Ŀռ乹��Ϊ___________��д����BF4-��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ��___________��___________��
N)4]BF4�У�ͭԭ�ӵļ۵��Ӳ�ʽΪ____________��BF4-�Ŀռ乹��Ϊ___________��д����BF4-��Ϊ�ȵ������һ�ַ��Ӻ�һ�����ӵĻ�ѧʽ��___________��___________��
��5��̼Ԫ���뵪Ԫ���γɵ�ij�־���ľ�����ͼ��ʾ��8��̼ԭ��λ��������Ķ��㣬4��̼ԭ��λ������������ģ�4����ԭ�����������ڣ����þ���Ӳ�ȳ������ʯ����Ϊ����һָ�ij�Ӳ�²��ϡ�
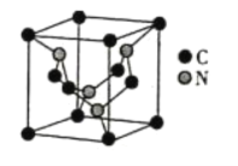
�پ�����Cԭ�ӵ���λ��Ϊ___________���þ���Ӳ�ȳ������ʯ��ԭ����___________��
����֪�þ����ı߳�Ϊapm�������ӵ�������NA��ʾ����þ�����ܶ�Ϊ___________g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�����(HBF4������ǿ��)����������Ǧ���صĵ������Һ����ʹǦ�����ڵ����¹���ʱ�����ܸ���������Ӧ����ʽΪ��Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O��Pb(BF4)2Ϊ������ˮ��ǿ����ʣ�����˵����ȷ����
2Pb(BF4)2+2H2O��Pb(BF4)2Ϊ������ˮ��ǿ����ʣ�����˵����ȷ����
A.���ʱ����������������23.9gʱת��0.2 mol����
B.�ŵ�ʱ��PbO2�缫������Һ��pH����
C.���ӷŵ�ʱ��������ӦΪPbO2+4HBF4-2e-=Pb(BF4)2+2HF4-+2H2O
D.���ʱ��Pb�缫�ĵ缫��ӦʽΪPbO2+H++2e-=Pb2++2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ--ѡ��5���л���ѧ����]
�����ϩ�����ڼ����������ܿ��پۺ�Ϊ ���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�
���Ӷ����н���ԣ�ij�������ϩ������G���ĺϳ�·�����£�

��֪��
��A����Է�����Ϊ58����Ԫ����������Ϊ0.276���˴Ź���������ʾΪ����
��
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ_______��
��2��B�Ľṹ��ʽΪ______����˴Ź���������ʾΪ______��壬�������Ϊ______��
��3����C����D�ķ�Ӧ����Ϊ________��
��4����D����E�Ļ�ѧ����ʽΪ___________��
��5��G�еĹ�������___�� ____ ��_____��������������ƣ�
��6��G��ͬ���칹���У���G������ͬ���������ܷ���������Ӧ�Ĺ���_____�֡������������칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2013���й�ˮ�ܵ������ǣ�����Լ����ˮ��Դ������������̬��������
��1��ClO2��Cl2����ԭ���ﶼΪCl�����������г��õľ�ˮ�������������ĵ����ʵ�������������ʱ��ClO2������Ч����Cl2��_________����
��2��ij��ɫ��ˮ�п��ܺ���Fe3+��Al3+��Mg2+��Na+��NO3-��CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������̺��й�������ͼ��ʾ�������������ͼ����ͼ
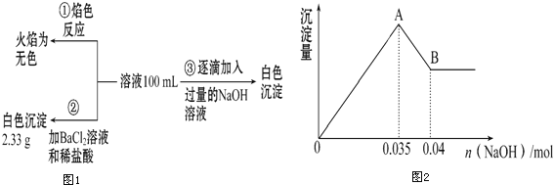
�������ͼ�ش��������⣺
��ʵ����������1.0molL��1��NaOH��Һ100mL�������������˲�������������ƽ����Ͳ��ҩ�ס��ձ�����ͷ�ιܣ���ȱ�ٵ�����Ϊ_______________��
��ʵ�����г�������A��B��������������Ӧ�����ӷ���ʽΪ___________��
����ȷ��NO3-�Ƿ���ڣ�________����������������������������ȷ�������������ڣ��Լ���c��NO3-��=_____���������ڣ����ʲ������𣩣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2+O2=2H2O
(1)Ϊ�˼ӿ�÷�Ӧ���ʣ����ܲ�ȡ�Ĵ�ʩ��________(����ţ���ͬ)��
A��ʹ�ô��� B���ʵ����������Ũ�� C��������������� D���ʵ����ͷ�Ӧ���¶�
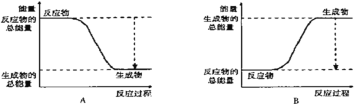
(2)�÷�Ӧ����______��Ӧ(��������������������)��
��ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��
(3)����ȼ�ϵ����ͼ��ʾ��
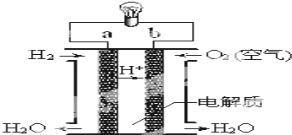
��aΪ________(��������������������)��b�缫����_____��Ӧ(����������������ԭ��)��
�����·�е��Ӵ�b�缫___,(��������������������)���ڵ�·������������____�� (����a������b��)��
��д����װ���������ϵĵ缫��Ӧʽ��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com