
【题目】太阳能电池板材料除单晶硅外,还有铜、硒、氮、硼、镓、镁、钙等化学物质。
(1)亚铜离子(Cu+)基态时的价电子排布式为__;
(2)氮元素的第一电离能在同周期中从大到小排第__位;写出与NO3-互为等电子体的一种非极性分子化学式__;
(3)H2Se的酸性比H2S__(填“强”或“弱”)。
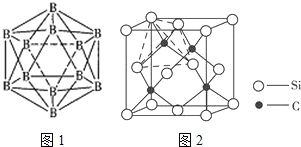
(4)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图1),其中有两个原子为10B,其余为11B,则该结构单元有__种不同的结构类型。
(5)如图2为碳化硅的晶胞(其中●为碳原子,○为硅原子)。
①三个碳原子和三个硅原子相间构成一个__式(船、椅)六元环。
②如果我们以一个硅原子为中心,则与硅原子次近的第二层有___个原子。
③已知:碳原子半径为a×10-8cm,硅子半径为b×10-8cm,假设碳、硅原子是刚性小球,在晶体中彼此相切,计算碳化硅晶体的密度为__g/cm3(只要求列出算式),查表知该密度比实测值偏小,其原因可能是__。
(6)在浓的CrCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为CrCl36H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为____。
(7)难溶碳酸盐受热易分解,试比较MgCO3和CaCO3的稳定性,并说明理由__。
【答案】3d10 3 SO3等 强 3 椅 12 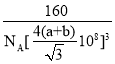 密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小 [TiCl(H2O)5]2+ CaCO3>MgCO3,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成
密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小 [TiCl(H2O)5]2+ CaCO3>MgCO3,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成
【解析】
(1)Cu原子价电子排布式为3d104s1,失去4s能级的1个电子形成Cu+;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,稀有气体的第一电离能最大;
原子数目相等、价电子总数也相等的微粒互为等电子体,分子中正负电荷重心重合的分子属于非极性分子(中心原子价电子全部成键);
(3)Se的原子半径大于S的,故H-Se不如H-S键稳定;
(4)两个10B有3位置,为图中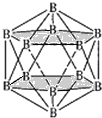 上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点;
上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中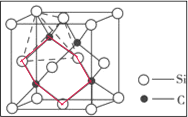 红线连接的原子,为椅式结构;
红线连接的原子,为椅式结构;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的![]() ,而晶胞体对角线长度为晶胞棱长的
,而晶胞体对角线长度为晶胞棱长的![]() 倍,据此算晶胞棱长,根据均摊法计算晶胞中Si、C原子数目,表示出晶胞的质量,再根据ρ=
倍,据此算晶胞棱长,根据均摊法计算晶胞中Si、C原子数目,表示出晶胞的质量,再根据ρ=![]() 计算晶体密度;
计算晶体密度;
Si、C原子之间形成共价键,原子间距小于二者原子半径之和,计算的体积比实际体积偏大;
(6)在浓的CrCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为CrCl36H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个Cl-、5个H2O,2个氯离子位于外界;
(7)分解生成金属氧化物,金属氧化物的晶格能大,更稳定,更易于生成。
(1)![]() 原子价电子排布式为
原子价电子排布式为![]() ,失去4s能级的1个电子形成
,失去4s能级的1个电子形成![]() ,
,![]() 基态时的价电子排布式为
基态时的价电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于同周期相邻元素的,稀有气体的第一电离能最大,故第二周期第一电离能:![]() ,
,
原子数目相等、价电子总数也相等的微粒互为等电子体,与![]() 互为等电子体的一种非极性分子化为
互为等电子体的一种非极性分子化为![]() 等,
等,
故答案为:3;![]() 等;
等;
(3)![]() 的原子半径大于S的,故H
的原子半径大于S的,故H![]() 不如
不如![]() 键稳定,在溶液中更溶液电离,故H
键稳定,在溶液中更溶液电离,故H![]() 的酸性比
的酸性比![]() 强,
强,
故答案为:强;
(4)两个![]() 有3位置,为图中
有3位置,为图中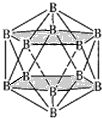 上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,
上下顶点位置,其中一个处于上顶点,另外的一个处于上层阴影中顶点,或者下层阴影中顶点,有3种结构,
故答案为:3;
(5)①三个碳原子和三个硅原子相间构成一个六元环为图中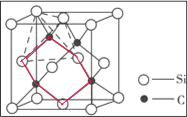 红线连接的原子,为椅式结构,
红线连接的原子,为椅式结构,
故答案为:椅;
②距离中心Si最近的第一层的4个C原子,每一个又连接着另外3个Si原子,则与硅原子次近的第二层有12个原子,
故答案为:12;
③黑色球连接周围的4个白色球形成正四面体结构,黑色球位于正四面体的中心,黑色球与晶胞顶点白色球连线处于晶胞体对角线上,且二者之间距离为体对角线长度的![]() ,而晶胞体对角线长度为晶胞棱长的
,而晶胞体对角线长度为晶胞棱长的![]() 倍,故晶胞棱长为
倍,故晶胞棱长为![]() ,晶胞中C原子数目为4,Si原子数目为
,晶胞中C原子数目为4,Si原子数目为![]() ,故晶胞质量为
,故晶胞质量为![]() ,故晶体密度为
,故晶体密度为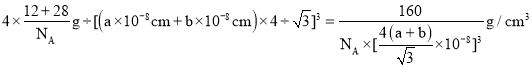 ,
,
密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小,
故答案为: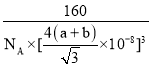 ;密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小;
;密度偏小,说明实际晶胞的体积下小于计算值,实际上碳、硅原子之间形成共价键,而不是相切,碳、硅原子间的距离比两个原子半径之和小;
(6)在浓的![]() 的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3
的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3![]() H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个
H2O的绿色晶体,该晶体中两配体的物质的量之比为1:5,则配体中有1个![]() 、5个
、5个![]() ,2个氯离子位于外界,则该配离子的化学式为
,2个氯离子位于外界,则该配离子的化学式为![]() ,
,
故答案为:![]() ;
;
(7)碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成,稳定性:![]() ,
,
故答案为:稳定性:![]() ,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成。
,碳酸盐的热分解是由于晶体中的阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果,产物中氧化镁和氧化钙都为离子晶体,因为镁离子半径小于钙离子半径则氧化镁晶格能大,更稳定,更易于生成。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、101kPa条件下,由H2、CH4组成的混合气体amL,通入一定量(设为xmL)氧气使其完全燃烧。
(1)若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即x=a),则原混合气体中CH4的体积分数是_____(保留三位有效数字);
(2)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:![]() 用推出的元素符号或者化学式作答
用推出的元素符号或者化学式作答![]()
(1)F的价电子排布式为__,B、C、D三种元素的第一电离能从大到小的顺序为___,D和E电负性较大的是__。
(2)BD32-中B原子的杂化方式为__,该离子的空间构型为__,键角为___。
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式__,化合物ABC中σ键和π键数目之比为___,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因__。
(4)B和C的最高价含氧酸的酸性较强的是___,过量的G与C的最高价含氧酸稀溶液反应的离子方程式为__。
(5)E和G形成的某种晶胞如图所示:其中白球表示E,黑球表示G。则该物质的化学式为___,假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为___cm。
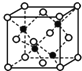
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向2L密闭容器中加入2molX、1molY。发生如下反应:2X(g)+Y(?) ![]() 3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
3Z(g) H<0。经60s达平衡,此时Y的物质的量为0.2mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是
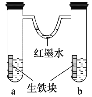
A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com