
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
【答案】B
【解析】
A.根据图像,pH =1.9时,溶液显酸性,c(H+)>c(OH-),根据电荷守恒,有c(Na+)+ c(H+)=c(HA-)+2c(A2-)+ c(OH-),因此c(Na+)<c(HA-)+2c(A2-),故A正确;
B.根据图像,当溶液中的溶质为NaHA,溶液显酸性,pH<7,此时溶液中存在物料守恒,c(Na+)=c(H2A)+c(HA-)+c(A2-),故B错误;
C.根据图像,pH=6时,c(HA-)>c(A2-),溶液中的溶质为NaHA和Na2A,c(Na+)>c(HA-)>c(A2一)>c(H2A),故C正确;
D.Ka2(H2A)=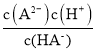 ,根据图像,当pH=7.2时,c(HA-)=c(A2一),则Ka2(H2A)=
,根据图像,当pH=7.2时,c(HA-)=c(A2一),则Ka2(H2A)=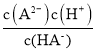 = c(H+)=10-7.2,因此lg[Ka2(H2A)]=-7.2,故D正确;
= c(H+)=10-7.2,因此lg[Ka2(H2A)]=-7.2,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4:l的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( )
A.①和③试管内溶液体积不等,溶质物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液中溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
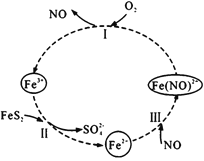
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用电解装置,探究“铁作阳极”时发生反应的多样性,实验过程如下。
(1)实验1:用KCl作电解质,一定电压下,按图1装置电解,现象如下:石墨电极上迅速产生无色气体,铁电极上无气体生成,铁逐渐溶解。5 min后U型管下部出现灰绿色固体,之后铁电极附近也出现灰绿色固体,10 min后断开K.按图2进行实验。
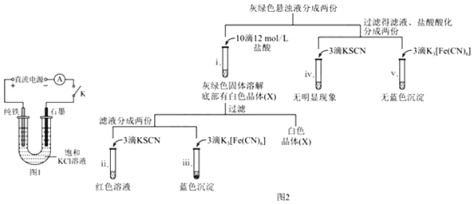
①石墨电极上的电极反应式是_____。
②确认灰绿色固体中含有Fe2+的实验现象是_____。
③灼烧晶体X,透过蓝色钴玻璃观察到火焰呈紫色。结合平衡移动原理,解释“试管i中析出白色晶体”的原因是_____。
(2)实验2:其他条件不变时,用图3装置重复实验,10 min后铁电极附近溶液依然澄清,断开K,按图4进行实验
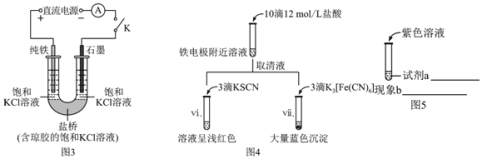
①结合图1和图2装置中现象的差异说明盐桥的作用是_____。
②对比图2和图4的现象,解释实验1和2中阳极附近实验现象不同的原因是:_____。
(3)实验3:用KOH作电解质
用图1装置电解浓KOH溶液,观察到铁电极上立即有气体生成,附近溶液逐渐变为淡紫色(![]() ),没有沉淀产生。
),没有沉淀产生。
①铁电极上OH-能够放电的原因是_____。
②阳极生成FeO![]() 的总电极反应式是_____。
的总电极反应式是_____。
③某同学推测生成的必要条件是浓碱环境,将图5中的实验方案补充完整,证实推测成立。试剂a:_____、现象b:_____。
(4)根据上述实验,“铁作阳极”时发生反应的多样性与_____有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的数值。下列说法正确的是
A.常温下,5.6g 铁粉投入足量的浓硝酸中,转移电子数为 0.3NA
B.0.5mol 环氧乙烷(![]() )中含有的共价键数目为 1.5NA
)中含有的共价键数目为 1.5NA
C.2.4g 镁条在足量的N2与O2的混合气体中完全燃烧,转移电子数为 0.2NA
D.25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应![]() ;ΔH <0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3 mol·L-1。则下列叙述正确的是( )
;ΔH <0,达到平衡后测得A气体的浓度为0.5mol·L-1;当恒温下将密闭容器的容积扩大两倍并再次达到平衡时,测得A的浓度为0.3 mol·L-1。则下列叙述正确的是( )
A. 平衡向右移动 B. x+y>z C. B的转化率提高 D. C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com