
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
【答案】D
【解析】
图中装置分析反应过程中,电子转移方向可知,高聚物失电子发生氧化反应,为原电池的负极,钠离子移向正极,正极上I3-得到电子发生还原反应生成I-,离子交换膜为阳离子交换膜,据此分析回答。
A.放电时,电子转移方向可知,高聚物在负极失电子发生氧化反应,A错误;
B.充电时,原电池正极为电解池的阳极,阳极的电极反应式为3I--2e-=I3-,B错误;
C.充电时,电极A接电源正极,作阳极,发生氧化反应,C错误;
D.结合放电过程中的电极反应式、电子守恒、电荷守恒计算,放电时,当转移0.5mol电子时,I3-+2e-=3I-,必有0.5mol钠离子通过阳离子交换膜进入正极室,故NaI溶液中增加0.5NA个Na+,D 正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】如图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答下列问题:
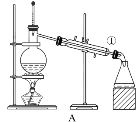
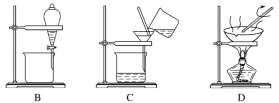
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置____。
(2)从碘水中分离出I2,选择装置___,该分离方法的名称为____。
(3)装置A中①的名称是____,进水的方向是____。装置B在分液时为使液体顺利滴下,应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图流程的实验:
![]()
问题1:精盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是____。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是___(从给定的四种装置中选择)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 棕红色NO2加压后颜色先变深后变浅
C. 高温及加入催化剂都能使合成氨的反应速率加快
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________(用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2BF3晶体Q,晶体Q在一定条件下可转化为R:
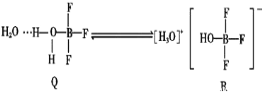
①晶体R中含有的化学键包括_________(填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________,阴离子中心原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________。
(5)Na3AlF6晶胞结构如图所示:
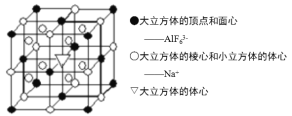
①位于大立方体体心▽代表________(填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______,其中_________%正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏加德罗常数为NA,则该晶体密度的计算表达式为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,将ag该晶体溶于bg水中恰好可形成VmL饱和溶液。下列关系中正确的是( )
A. 饱和溶液的物质的量浓度为![]() mol·L-1
mol·L-1
B. 饱和溶液中溶质的质量分数为![]() %
%
C. 25℃时R的溶解度为![]() g
g
D. 饱和溶液的密度为![]() g·L-1
g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
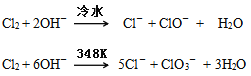
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型支管试管中装有1.5gKMnO4;③微型支管试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有2mol/LNaOH溶液;⑥、⑦双U形反应管中分别装有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5mol/LNa2S2O3溶液的棉花轻轻覆盖住

(1)整套装置气密性检查的方法_________________________。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为________________________________。
(3)装置⑥、⑦中能够观察到的实验现象分别是____________________。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸钾和氯化钾的溶解度曲线如下图所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是_____________。
(6)尾气处理时发生反应的离子方程式为____________________。
(7)选择微型实验装置的优点有___________________(至少写两点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com