
【题目】如图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答下列问题:
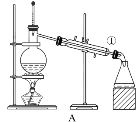
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置____。
(2)从碘水中分离出I2,选择装置___,该分离方法的名称为____。
(3)装置A中①的名称是____,进水的方向是____。装置B在分液时为使液体顺利滴下,应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图流程的实验:
![]()
问题1:精盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是____。
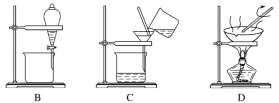
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是___(从给定的四种装置中选择)。
【答案】D A B 萃取、分液 (直形)冷凝管 下口进水 将分液漏斗上口的玻璃塞打开或使玻璃塞上的凹槽对准分液漏斗上的小孔 ad HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑ CD
【解析】
(1)从氯化钾溶液中得到氯化钾固体的方法是蒸发结晶,应选择D装置;除去自来水中的Cl-等杂质的方法是蒸馏,应选择A装置;
(2)从碘水中分离出I2,应该加入苯、四氯化碳等有机溶剂先进行萃取,然后再分液,应选择B装置;
(3)装置A中①的名称是(直形)冷凝管,其下口为进水口,上口为出水口;使用分液漏斗分液时,必须先打开分液漏斗上口的玻璃塞或使玻璃塞上的凹槽对准分液漏斗上的小孔,保证内外气压相同,使液体顺利滴下,然后再打开下端的旋塞;
(4)问题1:此题中除去SO42-应选用BaCl2溶液,Ca2+需用Na2CO3除去,NaOH用于除去Mg2+;而过量的BaCl2需用Na2CO3除去;过量的NaOH和Na2CO3需用盐酸除去。所以Na2CO3的作用有两个:既除去Ca2+又除去过量的BaCl2。所以,①Na2CO3溶液需在BaCl2溶液之后加,②盐酸在过滤除去沉淀之后加。只要满足这两个条件的答案均正确,所以答案选ad;
问题2:步骤④调节溶液的pH等于7,除去过量的Na2CO3和NaOH,发生两个反应:HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑;
问题3:由海水到氯化钠晶体的实验过程:加入沉淀剂→过滤→加入盐酸中和→蒸发结晶,所用的主要装置是C和D。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
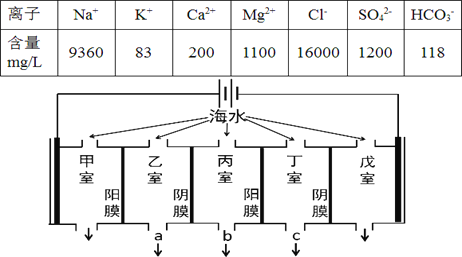
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室利用少量Cu片和过量浓硝酸制取NO2气体的装置。
(1)烧瓶中产生气体的颜色是_________;

(2)反应结束后,将烧瓶浸入冰水中,发生反应2NO2(g)![]() N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
N2O4(g)ΔH=-53kJ/mol。此时烧瓶内气体颜色______(填“变深”、“不变”或“变浅”),使用相关化学用语和必要的文字说明颜色变化的原因__________________________________。
(3)在80℃时,将0.40molN2O4气体充入2L已经抽成真空的固定容积的密闭容器I中发生反应,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①计算a=_________,此温度时该反应(N2O4作为反应物)的平衡常数K=_________。
反应达平衡时,共吸收热量________kJ。
②在其他条件不变时,改变条件,使反应再次达到平衡,能使c(NO2)/c(N2O4)比值变小的措施有(填字母)________。
A.降低温度 B.使用高效催化剂
C.升高温度 D.通入稀有气体,使容器内压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) △H1=+183kJ/mol
2NO(g) △H1=+183kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3=-1164.4kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料I | 1.0mol/L | 3.0mol/L | 0 |
投料II | 0.5mol/L | 1.5mol/L | 1.0mol/L |
①按投料I进行反应,测得达到化学平衡状态时H2的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
②L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,合成氨反应中H2(g)的平衡转化率随X
的变化关系。
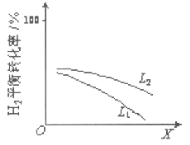
iX代表的物理量是_________,
ii判断L1、L2的大小关系,并简述理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
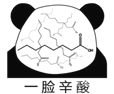
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
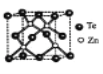
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com