
����Ŀ���� NA Ϊ�����ӵ���������ֵ������˵����ȷ����
A.�����£�5.6g ����Ͷ��������Ũ�����У�ת�Ƶ�����Ϊ 0.3NA
B.0.5mol ��������(![]() )�к��еĹ��ۼ���ĿΪ 1.5NA
)�к��еĹ��ۼ���ĿΪ 1.5NA
C.2.4g þ����������N2��O2�Ļ����������ȫȼ�գ�ת�Ƶ�����Ϊ 0.2NA
D.25��ʱ��Ksp(BaSO4)=1��10-10����BaSO4������Һ��Ba2+��ĿΪ1��10-5NA
���𰸡�C
��������
A�������£�����Ũ���ᷢ���ۻ�����ֹ�˷�Ӧ�Ľ��У���������ȫ��Ӧ�����ܼ���ת�Ƶĵ���������A����
B�����������к�4��C-H����1��C-C����2��C-O��������7�����ۼ�����0.5mol���������к��еĹ��ۼ���ĿΪ3.5NA����B����
C��2.4gþ�����ʵ���Ϊ0.1mol����þ��Ӧ���Ϊ+2�ۣ���0.1molþת��0.2NA�����ӣ���C��ȷ��
D������n=cV��֪����Һ���δ֪�������㱵������Ŀ����D����
��ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����Ҫ�Ĺ�ҵԭ���ϣ�����ͭ��������ͭ��ɵĻ���ij�о���ѧϰС��Ϊ��̽������������ȡ35.2 g��������0.5 L 3.4 mol��L��1��ϡ���ᣬ����������ȫ��Ӧ������һ������4.48 L(��״��)����������Һ�м���aL 2.0 mol��L��1����������Һ��ǡ��ʹ��Һ�е�ͭ���ӳ�����ȫ��
(1)������ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ_______________��
(2)������У�ͭ�����ʵ���Ϊ____________��������ͭ�����ʵ���Ϊ______________��
(3)��������������Һ�������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1 mol��L��Ԫ����H2A��Һ�еμ�0.1mol/LNaOH��Һ����Һ�е�H2A��HA-��A2 -�����ʵ���������(x)��pH�ı仯��ͼ��ʾ������˵���������

A.pH =1.9ʱ��c(Na+)��c(HA-)+2c(A2-)
B.��c(Na+)=c(H2A)+c(HA-)+c(A2-)ʱ����ҺpH��7
C.pH=6ʱ��c(Na+)��c(HA-)��c(A2-)��c(H2A)
D.lg[Ka2(H2A)]=-7.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���������X�ͷǽ�������Y�ܹ���Ӧ�����ɻ�����Z��Z����ˮ����ˮ�ⷴӦ��������G�Ͱ�ɫ����P�����¿�ͼ��ʾ������֪����G�����֮�ܶȱ�ԼΪ1.17������գ�
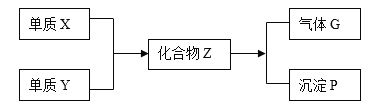
��1����ɵ���X��Y��Ԫ�طֱ�����____________��͵�___________�壻
��2��Z��ˮ����ˮ�ⷴӦ����ʽ_____________________��
��3��ÿ����1mol�Ļ�����Z����Ӧ��ת��_________________mol�ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʵ��Ʊ������ʡ��ռ�˵����ȷ���ǣ�������
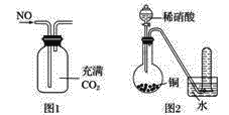
A.����β������NOx����Ҫ���������ʱ������������Ӧ�����
B.������ͼ1��ʾװ���ռ��������NO����
C.����ͼ2װ���ռ���������Ϊ��ɫ�ܹ���֤ͭ��ϡ���ᷴӦ�IJ�������̬����ֻ��NO
D.������ʪ��ĵ��۵⻯����ֽ�������ɫ����NO2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������˵����ȷ����
A.ij������Һ��pH=a��������Һϡ��10������Һ��pH=a+1
B.�ڵ��з�̪��Һ�İ�ˮ�У�����NH4Cl����Һǡ����ɫ�����ʱ��ҺpH<7
C.NH4Cl��Һ��Kw����NaCl��Һ��Kw
D.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��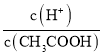 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5��m���������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣
(1)��PM2.5����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�������
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��/molL-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�PM2.5�������Ϊ_______��������pH=_______��
(2)Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�ǽ�úת��Ϊ�������ȼ�ϡ���֪��
H2(g)+![]() O2(g)=H2O(g) ��H=-241.8kJ��mol-1
O2(g)=H2O(g) ��H=-241.8kJ��mol-1
C(s)+![]() O2(g)=CO(g)��H=-110.5kJ��mol-1
O2(g)=CO(g)��H=-110.5kJ��mol-1
��C(s)+H2O(g)=CO(g)+H2(g)����H=________kJ��mol-1��
(3)����β����NOx��CO�����ɼ�ת��Ϊ��
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g) ��H��0����1mol��������0.8molN2��0.2molO2��1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⡣���NOΪ8��10-4mol��������¶��µ�ƽ�ⳣ��K=_______�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ����________��
2NO(g) ��H��0����1mol��������0.8molN2��0.2molO2��1300��ʱ���ܱ������ڷ�Ӧ�ﵽƽ�⡣���NOΪ8��10-4mol��������¶��µ�ƽ�ⳣ��K=_______�����������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ����________��
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)����֪�÷�Ӧ����H��0�������������ܷ�ʵ�ֵ����ݣ�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���·ۣ�BaSO4��ZnS���㷺���ڹ�ҵ�����У�������ZnSO4��BaS���������Ʊ����Դ�����п����Zn��CuO��FeO�����ʣ���BaSO4Ϊԭ���Ʊ����·۵��������£�
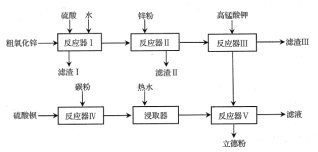
��1������ZnSO4�Ĺ����У���Ӧ����Ҫ����ǿ��ͨ�磬ԭ����___��
��2������п�۵���ҪĿ����___�������ӷ���ʽ��ʾ����
��3����֪KMnO4��������Һ�б���ԭΪMn2+���������ԡ���������Һ�б���ԭΪMnO2���ڼ�����Һ�б���ԭΪMnO42-���������жϣ�����KMnO4ʱ��Һ��pHӦ����___��
a��2.2~2.4 b��5.2~5.4 c��12.2~12.4
������ijɷ�Ϊ____��
��4���Ʊ�BaSʱ�������ʵ���֮�ȼ��㣬BaSO4��̼�۵�Ͷ�ϱ�Ҫ����1��2��Ŀ����__�����������л��������������뷴Ӧ��������Ӧ�����в�����β�����ü�Һ���գ�ԭ����__��
��5����ͨ���·ۣ�BaSO4��ZnS����ZnS����Ϊ29.4%����Ʒ����ӡ�����·���ZnS����Ϊ62.5%����ZnSO4��BaS��Na2SO4��Na2S��ѡȡ�����Լ��Ʊ���ӡ�����·ۣ���ѡ�Լ�Ϊ___����Ӧ�Ļ�ѧ����ʽΪ__����֪BaSO4��Է�������Ϊ233��ZnS��Է�������Ϊ97����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com