
����Ŀ��ij��ȤС�����õ��װ�ã�̽��������������ʱ������Ӧ�Ķ����ԣ�ʵ��������¡�
(1)ʵ��1����KCl������ʣ�һ����ѹ�£���ͼ1װ�õ�⣬�������£�ʯī�缫��Ѹ�ٲ�����ɫ���壬���缫�����������ɣ������ܽ⡣5 min��U���²����ֻ���ɫ���壬֮�����缫����Ҳ���ֻ���ɫ���壬10 min��Ͽ�K����ͼ2����ʵ�顣
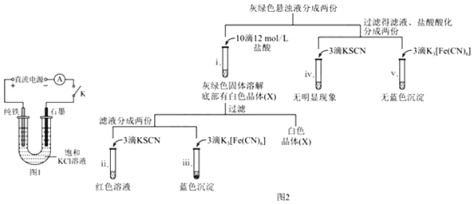
��ʯī�缫�ϵĵ缫��Ӧʽ��_____��
��ȷ�ϻ���ɫ�����к���Fe2+��ʵ��������_____��
�����վ���X������ɫ�ܲ����۲쵽�������ɫ�����ƽ���ƶ�ԭ�����������Թ�i��������ɫ��������ԭ����_____��
(2)ʵ��2��������������ʱ����ͼ3װ���ظ�ʵ�飬10 min�����缫������Һ��Ȼ���壬�Ͽ�K����ͼ4����ʵ��
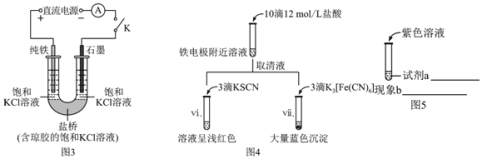
�ٽ��ͼ1��ͼ2װ��������IJ���˵�����ŵ�������_____��
�ڶԱ�ͼ2��ͼ4��������ʵ��1��2����������ʵ������ͬ��ԭ���ǣ�_____��
(3)ʵ��3����KOH�������
��ͼ1װ�õ��ŨKOH��Һ���۲쵽���缫���������������ɣ�������Һ��Ϊ����ɫ(![]() )��û�г���������
)��û�г���������
�����缫��OH-�ܹ��ŵ��ԭ����_____��
����������FeO![]() ���ܵ缫��Ӧʽ��_____��
���ܵ缫��Ӧʽ��_____��
��ijͬѧ�Ʋ����ɵı�Ҫ������Ũ�������ͼ5�е�ʵ�鷽������������֤ʵ�Ʋ�������Լ�a��_____������b��_____��
(4)��������ʵ�飬������������ʱ������Ӧ�Ķ�������_____�йء�
���𰸡�2H++2e-��H2������2H2O+2e-��2OH-+H2���� �Թ�iii��������ɫ�������Թ�v��û����ɫ���� �Թ�i�д����ܽ�ƽ�⣺KCl(s)K+(aq)+Cl-(aq)���μ�12 mol/L�����ᣬ����c(Cl-)��ƽ�������ƶ�������KCl���� �谭OH-������Ǩ�ƣ��������ɫ�������� ��ʵ�������������������IJ�����ҪΪFe2+��Fe2+�ڼ��������¸����ױ�����ΪFe3+ c(OH-)����Ӧ���ʼӿ죨�����ŵ磩 Fe��6e-+8OH-��![]() +4H2O ˮ ��ɫ��ʧ OH-��Ũ��
+4H2O ˮ ��ɫ��ʧ OH-��Ũ��
��������
��1����ʯī�缫�ǵ��ص��������缫�ϵĵ缫��Ӧ�������ӵõ����ӷ�����ԭ��Ӧ����������
�ڻ���ɫ�����������ܽ�����Һ�м������軯����Һ������ɫ��ɫ����������ɫ����Һ���˺����Һ�м������軯����Һ����ɫ�������ɣ�
�����չ���X����ɫ�ܲ����۲쵽����Ϊ��ɫ��˵������Ԫ�أ�����Ϊ�Թ�i�д����ܽ�ƽ�⣺KCl��s��K+ ��aq��+Cl����aq�����μ�12mol/L�����ᣬ����c��Cl������ƽ�������ƶ���
��2���������е������Ӵ��������������������ƶ����������������������ɣ�
������ʵ�����е�vi��vii��ii��v�е�ʵ������ȽϿ�֪��vii�м���Һ�����軯����Һ�����ɴ�����ɫ������˵����ʹ�����ŵ�ʵ�������£������������IJ���Ϊ�������ӣ�vi����Һ�м���KSCN��Һ����Һ��dz��ɫ��
II��KOH�������
��3��������������Ũ������Ӧ���ʼӿ죬���������ӻ�ŵ�����������
�����������ɵ������ܹ���������������ΪFeO![]() ��
��
���Ʋ�����FeO![]() �ı�Ҫ������Ũ�����ֻ��Ҫ�ı���Һ���Կ��Ƿ���Ȼ����FeO
�ı�Ҫ������Ũ�����ֻ��Ҫ�ı���Һ���Կ��Ƿ���Ȼ����FeO![]() ��
��
��4����������ʵ���������������������ʱӰ�췴Ӧ��������ء�
��1����ʯī�缫Ϊ��������Һ�е������ӷŵ������������缫��ӦʽΪ��2H++2e����H2����2H2O+2e����2OH��+H2�����ʴ�Ϊ��2H++2e����H2������2H2O+2e����2OH��+H2������
�ڻ���ɫ�����������ܽ�����Һ�м������軯����Һ��������ɫ����������ɫ����Һ���˺����Һ�м������軯����Һ������ɫ�������ɣ�˵������ɫ����Һ�к���Fe2+���ʴ�Ϊ���Թ�iii��������ɫ�������Թ�v��û����ɫ������
�����վ���X������ɫ�ܲ����۲쵽�������ɫ��˵�����м�Ԫ�أ�����Ϊ�Թ�i�д����ܽ�ƽ�⣺KCl��s��K+��aq��+Cl����aq�����μ�12 mol/L�����ᣬ����c��Cl������ƽ�������ƶ�������KCl���壬��ɫ����Ϊ�Ȼ��ؾ��壬�ʴ�Ϊ���Թ�i�д����ܽ�ƽ�⣺KCl��s��K+��aq��+Cl����aq�����μ�12 mol/L�����ᣬ����c��Cl������ƽ�������ƶ�������KCl���壻
��2���������е������Ӵ��������������������ƶ����������ɫ�������ɣ��ʴ�Ϊ���谭OH��������Ǩ�ƣ��������ɫ�������ɣ�
�ڸ���ʵ��I��vi��vii��ii��v�е�����ȽϿ�֪��vii�м������軯����Һ�����ɴ�����ɫ������˵����ʹ�����ŵ�ʵ�������������������IJ�����ҪΪFe2+��vi����Һ�ڼ���KSCN��Һ���dz��ɫ��˵��Fe2+�ڼ��������¸����ױ�����ΪFe3+���ʴ�Ϊ����ʵ�������������������IJ�����ҪΪFe2+��Fe2+�ڼ��������¸����ױ�����ΪFe3+��
��3����c��OH��������Ӧ���ʼӿ죬ʹ�����缫��OH���ܹ��ŵ磬�ʴ�Ϊ��c��OH��������Ӧ���ʼӿ죨�����ŵ磩��
�����������ɵ������ܹ�������������������FeO![]() ����Ӧ���ܵ缫��ӦʽΪ��Fe��6e��+8OH����FeO
����Ӧ���ܵ缫��ӦʽΪ��Fe��6e��+8OH����FeO![]() +4H2O���ʴ�Ϊ��Fe��6e��+8OH����FeO
+4H2O���ʴ�Ϊ��Fe��6e��+8OH����FeO![]() +4H2O��
+4H2O��
��Ҫ�Ʋ�����FeO![]() �ı�Ҫ������Ũ�����ֻ��Ҫ�ı���Һ�ļ��ԣ����Ƿ���Ȼ����FeO
�ı�Ҫ������Ũ�����ֻ��Ҫ�ı���Һ�ļ��ԣ����Ƿ���Ȼ����FeO![]() ���ɣ�ʵ�鷽��Ϊ��������ɫ��FeO42������Һ����ˮ��ϡ�ͣ�ʹ��Һ�ļ��Լ�����������Ӧ4FeO
���ɣ�ʵ�鷽��Ϊ��������ɫ��FeO42������Һ����ˮ��ϡ�ͣ�ʹ��Һ�ļ��Լ�����������Ӧ4FeO![]() +10H2O4Fe��OH��3��+8OH��+3O2����������ɫ��ʧ�����ɺ��ɫ��������ɫ���壬˵������FeO
+10H2O4Fe��OH��3��+8OH��+3O2����������ɫ��ʧ�����ɺ��ɫ��������ɫ���壬˵������FeO![]() �ı�Ҫ������Ũ������ʴ�Ϊ��ˮ����ɫ��ʧ��
�ı�Ҫ������Ũ������ʴ�Ϊ��ˮ����ɫ��ʧ��
��4����������ʵ���֪��������������ʱ������Ӧ�Ķ�������OH����Ũ���йأ��ʴ�Ϊ��OH����Ũ�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
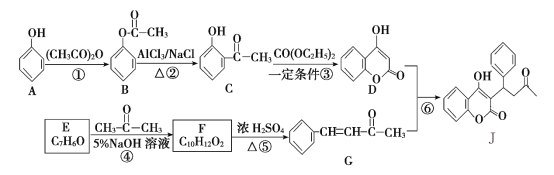
����Ŀ���л���J��һ�ַ�ֹѪ����Ѫ˨�γ��뷢չ��ҩ���ϳ�·����ͼ��ʾ (���ַ�Ӧ������ȥ)��
�ش��������⣺
(1)��Ӧ�ٵķ�Ӧ������________����Ӧ�ķ�Ӧ������________��
(2)J�ķ���ʽ��________��F�Ľṹ��ʽ��________��
(3)��Ӧ�۵Ļ�ѧ����ʽΪ___________________________________��
(4)д��ͬʱ��������������F������ͬ���칹��Ľṹ��ʽ________��
�ٱ�����ֻ���������ڶ�λ��ȡ��������
��1 mol���л������뺬2 mol NaOH����Һǡ����ȫ��Ӧ��
(5)����J�ĺϳ�·�ߣ����һ����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�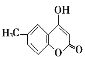 �ĺϳ�·��________��
�ĺϳ�·��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mlŨH2SO4��Һ���������м���3.2gCu���ڼ��������³�ַ�Ӧ��
��1����Ӧ���ĵ�H2SO4�����ʵ�����_____________����SO2�����Ϊ����״���£�____________mL��
��2���������Ũ��������ʵ���Ũ��Ϊamol/L��Ͷ��������ͭƬ���ȣ���ַ�Ӧ����ԭ����������ʵ���n��H2SO4��____0.025amol������ڡ��������ڡ���С�ڡ�����
��3��������з�Ӧ�����Һϡ�͵�500mL��ȡ��50mL������ȡ��Һ�м���������BaCl2��Һ���õ�����19.81g����ԭŨ��������ʵ���Ũ��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1 mol��L��Ԫ����H2A��Һ�еμ�0.1mol/LNaOH��Һ����Һ�е�H2A��HA-��A2 -�����ʵ���������(x)��pH�ı仯��ͼ��ʾ������˵���������

A.pH =1.9ʱ��c(Na+)��c(HA-)+2c(A2-)
B.��c(Na+)=c(H2A)+c(HA-)+c(A2-)ʱ����ҺpH��7
C.pH=6ʱ��c(Na+)��c(HA-)��c(A2-)��c(H2A)
D.lg[Ka2(H2A)]=-7.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ýȾ���������Լ��������ȡ�
(1)��������������м�ڵ���������ϡ�����Ƶã���ԭ����ΪNO����Ӧ�Ļ�ѧ����ʽΪ________��
(2)ijС��Ϊ̽����������������ȷֽ�������ͼ��ʾװ�ý���ʵ�顣
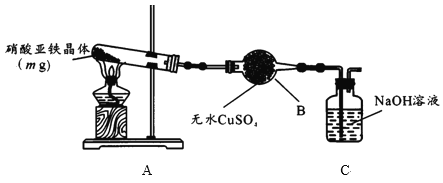
������B��������____��ʵ������ˮCuSO4�������ɴ˿�֪�����������庬��___��
��ʵ���й۲쵽Aװ�õ��Թ����к���ɫ�������ɣ������ȷֽ�����Ϊ��������ʵ�鷽��Ϊ��
ʵ�鲽�� | ���� |
ȡ�������������ϡ���ᣬ������Һ�ֳ����� | �����ܽ�û�ɫ��Һ |
һ�ݵ���____ | ��Һ��ɺ�ɫ |
��һ�ݵ���1��2��K3 [Fe(CN)6]��Һ | ___________ |
A��������������[Fe(NO3)2��xH2O]�ֽ�Ļ�ѧ����ʽΪ______ ��
(3)����̽��mg����������������Ԫ�ص���������
��ȡA���ȷֽ��Ĺ��������ƿ����ϡ�����ܽ⣬���������KI��Һ������2��___��ָʾ����
����a mol/LNa2S2O3����Һ�ζ���ƿ�е���Һ(��֪��I2+2S2O32-=2I-+S4O62-)���ζ����յ�ʱ��ȥbmLNa2S2O3��Һ������������������������������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���������X�ͷǽ�������Y�ܹ���Ӧ�����ɻ�����Z��Z����ˮ����ˮ�ⷴӦ��������G�Ͱ�ɫ����P�����¿�ͼ��ʾ������֪����G�����֮�ܶȱ�ԼΪ1.17������գ�
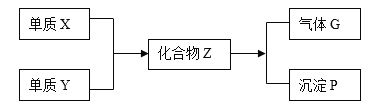
��1����ɵ���X��Y��Ԫ�طֱ�����____________��͵�___________�壻
��2��Z��ˮ����ˮ�ⷴӦ����ʽ_____________________��
��3��ÿ����1mol�Ļ�����Z����Ӧ��ת��_________________mol�ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ������˵����ȷ����
A.ij������Һ��pH=a��������Һϡ��10������Һ��pH=a+1
B.�ڵ��з�̪��Һ�İ�ˮ�У�����NH4Cl����Һǡ����ɫ�����ʱ��ҺpH<7
C.NH4Cl��Һ��Kw����NaCl��Һ��Kw
D.��0.1mol��L-1CH3COOH��Һ�м�������ˮ����Һ��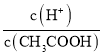 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.Ϊ���о�MnO2��˫��ˮ��H2O2���ķ�Ӧ���ʣ�ijѧ������������MnO2��ĩ��50mL�ܶ�Ϊ1.1g/cm3��˫��ˮ��Һ�У�ͨ��ʵ��ⶨ���ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ������ͼ�ش��������⣺

(1)�ų�һ����������Ҫ��ʱ��Ϊ______��
(2)A��B��C��D���㷴Ӧ���ʿ�����˳����________��
(3)����������Һ�ij�ʼ���ʵ���Ũ��Ϊ________��������2λС����
��.����β���ﺬ��NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��2404 ��ʱ��ƽ�ⳣ��K=64��10-4��
2NO(g)����H>0����֪�÷�Ӧ��2404 ��ʱ��ƽ�ⳣ��K=64��10-4��
(1)ij�¶��£���2 L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol��N2�ķ�Ӧ����Ϊ_________�� ��ʱN2 ��ת����______����
(2)�ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־_____(����ĸ���)��
A.����1mol N2ͬʱ����1mol O2 B.��������ܶȲ���
C.�������ƽ����Է����������� D.2v��(N2)=v��(NO)
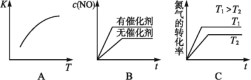
(3)��N2��O2�Ļ�����������º����ܱ������У�ͼ�仯������ȷ����________(����ĸ���)��
(4)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol��L-1��4.0��10-2mol��L-1��3.0��10-3mol��L-1����ʱ��Ӧv�� _____v����
(5)ij����������з�������ұ��������FeO(s)+C(s)=Fe(s)+CO(g) ��H��0����S��0��������Ӧ��_____�����»���£����������Է����С�
(6)���з�Ӧ��CO2(g)+H2(g)CO(g)+H2O(g) ��H��0����ͼ��ʾ��Ӧ����t1ʱ�̴ﵽƽ������t2ʱ����ı�ij�������������仯���������ͼ��t2ʱ�̷����ı������������_______��

A.�����¶�
B.�����¶�
C.�������
D.����ѹǿ
E.��Сѹǿ
F.����CO2
G.���������CO
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com