
【题目】下列除杂选用的试剂或操作方法正确的是
物质 | 杂质 | 除去杂质选用的试剂或操作方法 | |
A | KNO3溶液 | KOH | 加入适量氯化铁溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铜粉,并过滤 |
C | H2 | CO2 | 先后通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
D | 铁粉 | 铜粉 | 加入足量稀硫酸过滤 |
A.AB.BC.CD.D
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Z的原子序数是Y的原子序数的2倍,下列说法正确的是

A. 简单离子半径:X>Y>ZB. 氢化物的稳定性:Z<Y
C. 原子半径:W>Z>YD. 最高价氧化物对应水化物的酸性:W<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.H+、CO32-、NO3-B.Ca2+、SO42-、CO32-
C.NH4+、Cl-、SO42-D.Ag+、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工业流程如下:
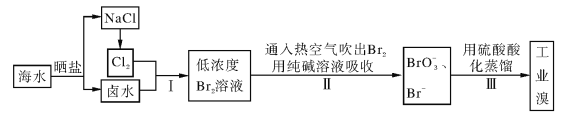
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____
![]() Br2+
Br2+![]() CO32-===
CO32-===![]() BrO3-+
BrO3-+![]() Br-+
Br-+![]() CO2↑
CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是_____。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行下列实验,在选择实验装置时应当考虑冷凝回流装置的是( )
A.葡萄糖与银氨溶液共热制银镜
B.用蒸馏烧瓶从石油中提取汽油
C.苯与浓硝酸、浓硫酸共热制硝基苯
D.乙醇、丁酸与浓硫酸共热制丁酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C三种化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4。A和C分子中,其原子个数比都为1:1,B分子中原子个数比为1:2。由两种短周期元素组成的双核D离子中含有10个电子,它与A、B分子均能反应,生成一种常见的10电子分子E。请回答下列问题:
(1)C的化学式为_____。A的还原性______B的还原性(填“大于”或“小于”)
(2)写出B与D在溶液中反应的离子方程式__________。
(3)气态的A分子遇到某10电子分子会产生白烟,请写出该白烟成分的电子式_______;该白烟的水溶液与浓的含D离子的溶液在受热条件下反应的离子方程式为_________。
(4)写出一个含有18电子的五原子分子的化学式_______,其中的一种元素形成的单质可被含D离子的溶液腐蚀,发生反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应
C. ③的气体产物中检测出CO2,说明木炭一定与浓硝酸发生了反应
D. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、量筒、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算,应选择下列________。
A.需要CuSO4固体8 g B.需要CuSO4·5H2O晶体12.0 g
C.需要CuSO4·5H2O晶体12.5 g D.需要CuSO4固体7.7 g
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是____________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了________。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”“偏低”或“无影响”)。
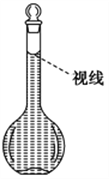
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com