
【题目】下列各组离子在水溶液中能够大量共存的是( )
A.H+、CO32-、NO3-B.Ca2+、SO42-、CO32-
C.NH4+、Cl-、SO42-D.Ag+、Na+、Cl-
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

(1)氢氧燃料电池的在导线中电流的方向为由______(用a、b表示)。
(2)负极反应式为______,正极反应式为___________。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O=LiOH+H2↑
2LiH Ⅱ LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是_________,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和 CH3COOH溶液。利用传感器测得滴定过程中溶液 的电导率如图所示。下列说法不正确的是
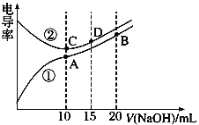
A. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)= 0.0500 mol·L-1
B. 曲线②代表滴定CH3COOH溶液的曲线
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A>C>B
D. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学设计了如图所示装置来探究铜跟浓硫酸的反应。
先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失。

(1)请写出上述过程A装置中所涉及的化学反应方程式。
________________________
_________________________
(2)实验中加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片为什么有剩余?请简述其原因是:___________。
(3)老师认为实验中B装置设计有误,请你帮助小明进行修改:___________。
(4)B中所收集到的气体既具有氧化性又具有还原性,请写出该气体与O2反应的化学方程式:______。
(5)装置C中应盛放____溶液,其作用是:____,所发生的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生产、生活密切相关,下列说法正确的是( )
A.“火树银花”中的焰火实质上是金属元素的焰色反应
B.从海水提取物质都必须通过化学反应才能实现
C.二氧化硫可广泛用于食品的漂白
D.“玉不琢不成器”“百炼方能成钢”发生的均为化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“价——类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:
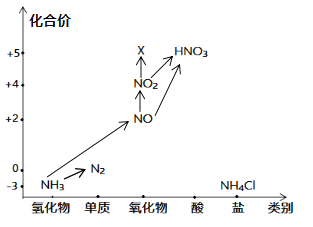
(1)图中,X的化学式为_____,从N元素的化合价看,X具有_____性(“氧化”、“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为______。
②下列试剂不能用于干燥NH3的是______(填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③请写出NH3→NO的化学方程式_____________ 。
④工业生产中利用氨水吸收SO2和NO2,原理如下图所示:
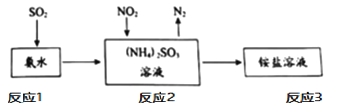
请写出反应2中NO2被吸收过程的化学反应程式是_____。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。SCR(选择性催化还原)工作原理:

①已知尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出SCR催化反应器中NH3还原NO2的化学方程式:_________。
②尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol 1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂选用的试剂或操作方法正确的是
物质 | 杂质 | 除去杂质选用的试剂或操作方法 | |
A | KNO3溶液 | KOH | 加入适量氯化铁溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铜粉,并过滤 |
C | H2 | CO2 | 先后通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
D | 铁粉 | 铜粉 | 加入足量稀硫酸过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.离子化合物中一定含离子键
B.离子化合物中一定不存在分子
C.离子化合物中一定含有金属元素
D.离子键只存在于离子化合物中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com