
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

��1������ȼ�ϵ�ص��ڵ����е����ķ���Ϊ��______(��a��b��ʾ)��
��2��������ӦʽΪ______��������ӦʽΪ___________��
��3���õ�ع���ʱ��H2��O2�������ⲿ����,��ؿ����������ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
�� 2Li+H2![]() 2LiH �� LiH+H2O=LiOH+H2��
2LiH �� LiH+H2O=LiOH+H2��
�ٷ�Ӧ���еĻ�ԭ����_________����Ӧ���е���������_____��
����֪LiH�����ܶ�Ϊ0.82g��cm-3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ______��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ___mol��
���𰸡���b��a 2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O O2 + 2H2O + 4e-=4OH- Li H2O ![]() ��8.71��10-4 32
��8.71��10-4 32
��������
(1)ԭ�����Ҫ�ǽ���ѧ��ת��Ϊ���ܣ�����ʧȥ���ӣ�Ϊ����,������õ��ӣ�Ϊ�����������ɸ���ͨ����������������
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ��
(3)�ٸ��ݻ��ϼ۵ı仯�жϣ�����LiH������ΪvL��������������ʵ�������������������۸���ʵ�ʲμӷ�Ӧ�������Լ��缫��Ӧʽ���㡣
(1)ȼ�ϵ����ԭ��أ��ǽ���ѧ��ת��Ϊ���ܵ�װ�ã�����ʧȥ���ӣ�Ϊ������������õ��ӣ�Ϊ�����������ɸ���ͨ��������������������a��b��
(2)����������ʧ���Ӻ����������ӷ�Ӧ����ˮ���缫��ӦʽΪ2H2+4OH--4e-=4H2O��H2+2OH--2e-=2H2O������Ϊ�����õ����ӣ����ڵ������ҺΪ���ԣ������õ����Ӻ�ˮ����OH-������ʽΪO2 + 2H2O + 4e-=4OH-��
(3) 2Li+H2![]() 2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
2LiH���⻯��У�Li�Ļ��ϼ�Ϊ+1����Ӧ���ʧ���ӷ���������Ӧ����ǻ�ԭ������ LiH+H2OLiOH+H2�����÷�Ӧ��H2O�õ�������������������ԭ��Ӧ��H2O����������
�ڸ��ݻ�ѧ��Ӧ����ʽ��2n(H2)=n(LiH)���������224 LH2��Ϊ10mol�������ɵ�LiHΪ20mol��������Ϊ20mol��(7��1)=160g��![]() �����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
�����ɵ�LiH����뱻���յ�H2�����Ϊ195cm3:224L��8.7��10��4��
��20molLiH��������20molH2��ʵ�ʲμӷ�Ӧ��H2Ϊ20mol%80%=16mol��1molH2ת��Ϊ1molH2O��ת��2mol���ӣ�����16molH2��ת��32mol�ĵ��ӡ�


 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ������ȷ���� ( )
A. 1��������Ũ�����ᷴӦ��CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O
CH3CH2CH2Br + H2O
B. Ӳ֬�����Ҵ���������Ӧ��C17H35COOH + C2H518OH ![]() C17H35COOC2H5 + H218O
C17H35COOC2H5 + H218O
C. ��CH2BrCOOH�м�������������������Һ�����ȣ�CH2BrCOOH + OH�� ![]() CH2BrCOO�� + H2O
CH2BrCOO�� + H2O
D. �������������������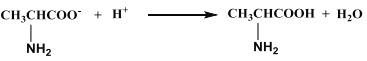
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�а�������Ϣ����������������ȷ���� ( )
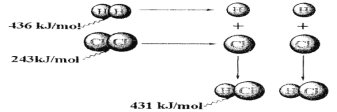
A��������������Ӧ����1 mol�Ȼ������壬��Ӧ����248 kJ������
B��436 kJ/mol��ָ�Ͽ�1 mol H2�е�H��H����Ҫ�ų�436 kJ������
C��������������Ӧ����2 mol�Ȼ������壬��Ӧ�ų�183 kJ������
D��431kJ/mol��ָ����2 mol HCl�е�H��Cl����Ҫ�ų�431 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��Ԫ�����ʵ�˵����ȷ����
A. �ǽ���Ԫ����ɵĻ�������ֻ�����ۼ�
B. IA�����Ԫ����ͬ�����н�������ǿ��Ԫ��
C. ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ���ʵ���������������
D. VIIA��Ԫ�ص��������Ի�ԭ��Խǿ��������������Ӧˮ���������Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AlN����һ���������ǽ������ϣ�ijAlN��Ʒ������Al2O3���ʣ�Ϊ�ⶨAlN�ĺ����������������ʵ�鷽������֪��AlN+NaOH+H2O��NaAlO2��NH3��
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
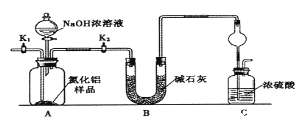
��1����ͼCװ�������θ���ܵ�������______________��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã�����______���ټ���ʵ��ҩƷ����������ʵ�������____,��Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����______________��
��3������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����_________��
������2��������ͼװ�òⶨm g��Ʒ��A1N�Ĵ���(���ּг�װ������ȥ)��
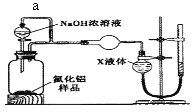
��4������a����Ҫ������______________��
��5��Ϊ�ⶨ������������������װ���е�XҺ�������____________������ѡ����ţ�
a��CCl4 b��H2O c��NH4Cl��Һ d��![]()
��6����mg��Ʒ��ȫ��Ӧ�����������������ΪVmL,����ת��Ϊ��״��������A1N����������Ϊ___���ú�V��m�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ǧ���صĹ���ԭ��ʾ��ͼ������ܷ�Ӧʽ��Pb��PbO2��2H2SO4 ![]() 2PbSO4��2H2O������˵����ȷ���ǣ�������
2PbSO4��2H2O������˵����ȷ���ǣ�������
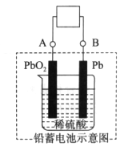
A. �ŵ�ʱ��PbO2������
B. ���ʱ������Ũ������
C. ���ʱ��BӦ���Դ����������
D. �ŵ�ʱ��������Ӧ��Pb��2e����SO42����PbSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����������ȼ�ϵ��Ϊ��Դ���еĵ��ʵ�顣����˵������ȷ����(����)
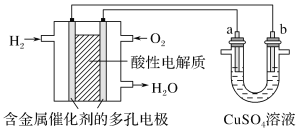
A. ȼ�ϵ�ع���ʱ��������ӦΪ��O2��2H2O��4e����4OH��
B. a��������b����ͭʱ��b�����ܽ⣬a������ͭ����
C. a���Ǵ�ͭ��b���Ǵ�ͭʱ��a�����ܽ⣬b������ͭ����
D. a��b��������ʯīʱ��a���ϲ�����O2���������ĵ� H2�����Ϊ ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ������Ԫ�أ����������ڱ������λ����ͼ��ʾ����Z��ԭ��������Y��ԭ��������2��������˵����ȷ����

A. �����Ӱ뾶��X>Y>ZB. �⻯����ȶ��ԣ�Z��Y
C. ԭ�Ӱ뾶��W>Z>YD. ����������Ӧˮ��������ԣ�W��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܹ�����������ǣ� ��
A.H+��CO32-��NO3-B.Ca2+��SO42-��CO32-
C.NH4+��Cl-��SO42-D.Ag+��Na+��Cl-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com