
����Ŀ����������AlN����һ���������ǽ������ϣ�ijAlN��Ʒ������Al2O3���ʣ�Ϊ�ⶨAlN�ĺ����������������ʵ�鷽������֪��AlN+NaOH+H2O��NaAlO2��NH3��
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
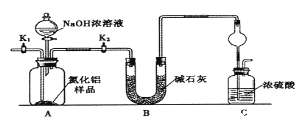
��1����ͼCװ�������θ���ܵ�������______________��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã�����______���ټ���ʵ��ҩƷ����������ʵ�������____,��Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����______________��
��3������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����_________��
������2��������ͼװ�òⶨm g��Ʒ��A1N�Ĵ���(���ּг�װ������ȥ)��
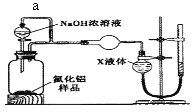
��4������a����Ҫ������______________��
��5��Ϊ�ⶨ������������������װ���е�XҺ�������____________������ѡ����ţ�
a��CCl4 b��H2O c��NH4Cl��Һ d��![]()
��6����mg��Ʒ��ȫ��Ӧ�����������������ΪVmL,����ת��Ϊ��״��������A1N����������Ϊ___���ú�V��m�Ĵ���ʽ��ʾ����
���𰸡���ֹ�������װ�������Թر�K1����K2��װ���в����İ���ȫ������Cװ��Cװ�ó��ڴ�����һ������װ�ñ�����ѹ�㶨��ʹNaOHŨ��Һ�������£�����������Һ������������������Ӱ��ad[41V/22400m]��100%
��������
��1����������Ũ�����ܷ�����Ӧ�����壬����������ͼCװ�������θ���ܵ������Ƿ�ֹ���������ã��ʴ�Ϊ����ֹ������
��2����װ��ʵ��װ�ã���Ҫ�ȼ��װ�������ԣ�����ʵ��ҩƷ����������ʵ������ǹر�K1����K2����Һ©������������NaOHŨ��Һ�������ٲ������壬��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ���ǣ���Ӧ���ɰ���������װ���е�����ȫ������װ��C��Ũ�������գ�ȷ�ⶨװ��C�����ؼ��㣬�ʴ�Ϊ�����װ�������ԣ��ر�K1����K2����װ���в����İ���ȫ������Cװ�ã�
��3��װ�ô���ȱ���ǿ����е�ˮ�����Ͷ�����̼Ҳ���Խ���װ��C��ʹ�ⶨ���ƫ�ߣ���Ҫ����һ��ʢ��ʯ�Ҹ���ܣ��ʴ�Ϊ��Cװ�ó��ڴ�����һ������װ�ã�
��4������a���Ա��ַ�Һ©���Ϸ��ͷ�Ӧװ���ڵ���ѹ�㶨��ʹNaOHŨ��Һ�������£��ʴ�Ϊ��������ѹ�㶨��ʹNaOHŨ��Һ�������£�
��5��a��CCl4�����ܽⰱ���������������Ȼ�̼��Һ�ķ����ⶨ�����������a��ȷ�� b��������������ˮ��������ˮ���ⶨ����b���� c��������������ˮ����������NH4Cl��Һ�ķ����ⶨ�����������c���� d�����������ڱ������������ű���Һ���ⶨ�������������d��ȷ���ʴ�Ϊ��ad��
��6����m g��Ʒ��ȫ��Ӧ�����������������ΪV mL����ת��Ϊ��״������AlN+NaOH+H2O�TNaAlO2+NH3��
41 22.4L
m V��10-3L
m=![]() g����AlN����������=
g����AlN����������=![]() ��100%=
��100%=![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ��![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������� RO3n ��, ���� x ��������ӣ�R ԭ�ӵ�������Ϊ A���� R ԭ�Ӻ��ں��е�������Ŀ��( )
A. A��x��n��24 B. A��x��n��48
C. A��x��n��24 D. A��x��n��24
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У������ʡ������������˳��������ȷ���ǣ�����
A.��ʯ�ҡ���ʯ�ҡ���ˮ�����B.������Ũ���ᡢ����
C.�ɱ� �������Ȼ���D.ˮ����ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ����ǿ������Һ���ܴ���������ǣ� ��
A.K+��Na+��OH-��Cl��
B.Na+��K+��Cl����SO42-
C.Ca2+��Na+��CO32-��NO3-
D.Cu2+��SO42-��Mg2+��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��ǿ�ҵ�������γɽ�����������
A.��������B.ԭ��C.����D.���������Ӻ����ɵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2����Fe3����Al3����Ba2����NH4+��CO32-��NO3-��SO42-��SiO32-�е������֣���ȡX��Һ��������ʵ�飬ʵ����̼�������ͼ��ʾ��ʵ���������һ������Ϊ����ɫ��

����������Ϣ���ش��������⣺
(1)��ǿ�������������ж�X��Һ�п϶������ڵ�������________________��
(2)��ҺX�й�����������ӵ��жϣ���ȷ����______(���ţ���ͬ)��
a��һ������ ��b��һ�������� ������c�����ܺ���
(3)����F�ĵ���ʽΪ____________��������I�к��еĻ�ѧ��������________________��
(4)ת���ٵ����ӷ���ʽΪ_______________________________________________________��
ת���ߵ����ӷ���ʽΪ_______________________________________________________��
(5)�Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������________��
��NaOH��Һ����KSCN��Һ������ˮ��KSCN�Ļ����Һ����pH��ֽ����KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·���е�ͭ�����Ȼ�ѧ����ʽΪCu(s)��H2O2(l)��2H��(aq)===Cu2��(aq)��2H2O(l)����H��֪��Cu(s)��2H��(aq)===Cu2��(aq)��H2(g)�� ��H1����64 kJ��mol��1��2H2O2(l)===2H2O(l)��O2(g)�� ��H2����196 kJ��mol��1��H2(g)��1/2O2(g)===H2O(l)�� ��H3����286kJ��mol��1������˵������ȷ����
A. ��Ӧ�ٿ�ͨ��ͭ���缫���ϡH2SO4�ķ���ʵ��
B. ��Ӧ�����κ������¶����Է�����
C. ��H2(g)+1/2O2(g)===H2O(g)����H4������H4<��H3
D. ��H����320 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˶����ⶨŨ�������ǿ�����Ե����Ũ�ȣ�ij�о�С����Ƶ�ʵ�鷽��Ϊ��ȡ18.4mol��L-1Ũ����a mL������п��A�з�Ӧ�������ɵ�����ͨ��ij��Һ���ⶨ���ɳ�����������
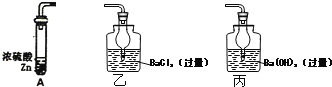
��1��A�в���������Ӧͨ��ͼ��__________����ҡ�������װ�ã�
��2����ͬѧ��ΪҪ��Сʵ������Ҫ����һ������Ӧ���ɵ�SO2ȫ���ų��IJ�������Ҳ��ͬѧ��Ϊû�б�Ҫ����������____________________________________��
��3������������Ϊb g����Ũ�������ǿ������ʱ�����Ũ��Ϊ________________������ ��a��b�Ĵ���ʽ��ʾ�����Է�Ӧ������Ũ��������仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�
A. ���ӵ�ء�Ǧ���غͼ���п�̸ɵ�ض��Ƕ��ε��
B. ��ѧ��صķ�Ӧ������������ԭ��Ӧ
C. ����ȼ�ϵ���ڸ���ͨ���������
D. ��п��أ�2Ag+Zn(OH)2![]() Ag2O+Zn+H2O���ŵ�ʱ�������Ϸ�����Ӧ����Ag
Ag2O+Zn+H2O���ŵ�ʱ�������Ϸ�����Ӧ����Ag
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com