
【题目】在离子 RO3n 中, 共有 x 个核外电子,R 原子的质量数为 A,则 R 原子核内含有的中子数目是( )
A. A-x+n+24 B. A-x+n+48
C. A-x-n-24 D. A+x-n-24
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如图:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 地壳中含量最多的元素 |
Z | 单质和化合物的焰色反应为黄色 |
W | M层有7个电子 |
下列选项中错误的是
A. 考古时利用X元素的某种同位素原子测定一些文物的年代
B. Y和Z两种元素只能形成一种化合物
C. 工业上可以利用W元素的单质与石灰乳制漂白粉
D. 化合物ZW可以通过蒸发海水制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的烟气含有的SO2,是大气主要污染物之一。减少煤燃烧对大气造成的污染,应从多方面采取措施。
(1)在煤燃烧前需对煤进行脱硫处理。
①一种烟气脱硫技术是向煤中加入适量石灰石,可大大减少燃烧产物中SO2的含量,最后生成CaSO4,该反应的化学方程式为_________________________________________。
②煤炭中以FeS2(铁元素为+2价)形式存在的硫,可以采用微生物脱硫技术脱去,其原理如图所示:
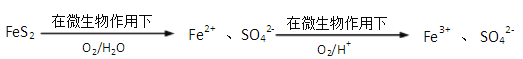
1mol FeS2完全转化为Fe3+ 和SO42-时,FeS2与O2物质的量之比为_____________。
(2)燃煤后烟气脱硫方法之一是利用天然海水的碱性吸收烟气中SO2并转化为无害的SO42-,其流程的示意图如下:
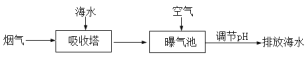
①海水中碳元素主要以HCO3-的形式存在。用离子方程式表示海水呈碱性的原因:_____________。
②研究表明,进入吸收塔的海水温度越低,SO2的脱除效果越好,主要原因是_____________。
③从吸收塔排出的海水呈酸性,并含有较多的HSO3-,排入曝气池进行处理时,需要鼓入大量空气。空气的作用是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)玻璃棒是化学实验中常用的仪器之一,其主要用于搅拌、过滤或转移液体时的引流。下列实验过程中,通常不需要使用玻璃棒的是___________(填序号,下同)
①用pH试纸测定Na2CO3溶液的pH
②用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
③实验室中用FeCl3溶液和沸水制取Fe(OH)3胶体
④用已知浓度的稀盐酸滴定未知浓度的氢氧化钠溶液
⑤取某溶液做焰色反应实验,检验该溶液中是否含有钠元素
(2)①下列仪器在使用前一定要检查是否漏液的是______________________。
a.容量瓶 b.冷凝管 c.碱式滴定管 d.长颈漏斗 e.分液漏斗
②检查装置气密性是化学实验中的重要操作之一。不进行气密性检查可能导致的后果是____________。
a.收集不到气体 b.造成环境污染
c.观察到的实验现象有误 d.引发爆炸事故
(3)下图所示装置可用于制备某种干燥的纯净气体。该装置中所盛装的药品正确的是_____________。
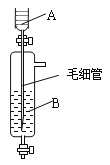
a.A中装浓硫酸,B中装浓盐酸
b.A中装浓盐酸,B中装浓硫酸
c.A中装氢氧化钠浓溶液,B中装浓氨水
d.A中装浓氨水,B中装氢氧化钠浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备。请回答下列有关问题:
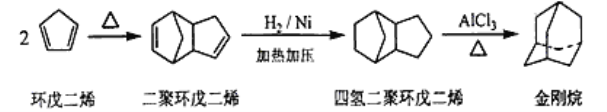
(1)环戊二烯分子中最多有____________个原子共平面。
(2)金刚烷的分子式为_________,其分子中的—CH2—基团有______个,金刚烷的一氯代物有______种。
(3)由环戊二烯生成二聚环戊二烯的反应类型是_______。
(4)已知烯烃能发生如下反应:![]() RCHO+R’CHO,请写出下列反应产物的结构简式:
RCHO+R’CHO,请写出下列反应产物的结构简式: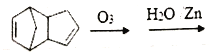 _________________,该产物中官能团的名称是___________________。
_________________,该产物中官能团的名称是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产苯乙烯是利用乙苯的脱氢反应如下,针对上述反应,在其它条件不变时,下列说法正确的是( )

A. 加入适当催化剂,可以提高苯乙烯的产量
B. 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C. 仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D. 加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________;
(2)简述银氨溶液的配制过程:__________________________________________;
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________;
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:![]()
已知:[Ag(NH3)2]+![]() Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________;
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
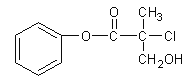
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
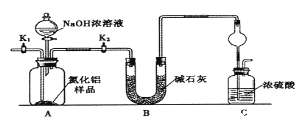
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
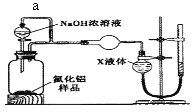
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com