
����Ŀ����������������άͼ��ѧϰԪ�ػ�����֪ʶ�ĺ÷���������ͼ�е�Ԫ�ؼ��仯�����ת����ϵ���ش����⣺
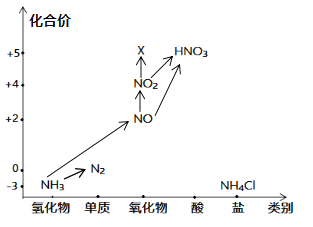
��1��ͼ�У�X�Ļ�ѧʽΪ_____����NԪ�صĻ��ϼۿ���X����_____��(��������������ԭ��)��
��2���ش����й���NH3�����⣺
��ʵ���ҳ���NH4Cl��Ca(OH)2��ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ______��
�������Լ��������ڸ���NH3����______(����ĸ)��
A��Ũ���� B����ʯ�� C��NaOH����
����д��NH3��NO�Ļ�ѧ����ʽ_____________ ��
�ܹ�ҵ���������ð�ˮ����SO2��NO2��ԭ������ͼ��ʾ��
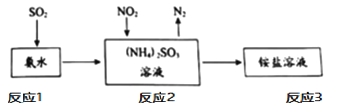
��д����Ӧ2��NO2�����չ��̵Ļ�ѧ��Ӧ��ʽ��_____��
��3��SCR��NSR��������Ч���Ͳ��ͷ������ڿ������������µ�NOx�ŷš�SCR(ѡ���Դ���ԭ)����ԭ����

����֪����[CO(NH2)2]ˮ��Һ�ȷֽ�ΪNH3��CO2����д��SCR����Ӧ����NH3��ԭNO2�Ļ�ѧ����ʽ��_________��
��������ҺŨ��Ӱ��NO2��ת�����ⶨ��Һ������(M=60g��mol 1)�����ķ������£�ȡag������Һ������������ȫת��ΪNH3������NH3�ù�����v1mLc1mol��L1 H2SO4��Һ������ȫ��ʣ��H2SO4��v2mLc2mol��L1 NaOH��Һǡ���кͣ���������Һ�����ʵ�����������____��
���𰸡�N2O5 ������ Ca(OH)2+2NH4Cl ![]() CaCl2 + 2NH3��+2H2O a 4NH3 + 5O2
CaCl2 + 2NH3��+2H2O a 4NH3 + 5O2 ![]() 4NO + 6H2O 2NO2 + 4(NH4)2SO3 = N2 + 4(NH4)2SO4 8NH3+6NO2
4NO + 6H2O 2NO2 + 4(NH4)2SO3 = N2 + 4(NH4)2SO4 8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O ![]()
��������
(1)XΪ�����������Ԫ�صĻ��ϼ�Ϊ+5�ۣ������仯ѧʽΪN2O5 ����Ԫ�ش�����ۣ����������ԣ�
(2) ���Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�������ˮ������ʽΪ��Ca(OH)2+2NH4Cl ![]() CaCl2 + 2NH3��+2H2O��
CaCl2 + 2NH3��+2H2O��
���������ڼ������壬������Ũ��������ѡa��
�������Ĵ�������Ӧ����һ������������ʽΪ��4NH3 + 5O2 ![]() 4NO + 6H2O��
4NO + 6H2O��
����ͼ���������������еĵ�Ԫ�ػ��ϼ۽��ͣ������������Ԫ�ػ��ϼ����ߣ�����ʽΪ��2NO2 + 4(NH4)2SO3 = N2 + 4(NH4)2SO4 ��
(3) ����ͼ�����������Ͷ���������Ӧ���ɵ�����ˮ������ʽΪ��8NH3+6NO2![]() 7N2+12H2O��
7N2+12H2O��
������CO(NH2)2---2NH3---H2SO4�������Ͱ�����Ӧ����������ʵ���Ϊ(c1v1-c2v2/2) ��10-3mol�������ص����ʵ���Ϊ(c1v1-c2v2/2) ��10-3mol����������Ϊ![]() =
=![]() ��
��


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ǧ���صĹ���ԭ��ʾ��ͼ������ܷ�Ӧʽ��Pb��PbO2��2H2SO4 ![]() 2PbSO4��2H2O������˵����ȷ���ǣ�������
2PbSO4��2H2O������˵����ȷ���ǣ�������
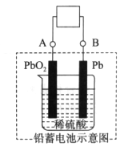
A. �ŵ�ʱ��PbO2������
B. ���ʱ������Ũ������
C. ���ʱ��BӦ���Դ����������
D. �ŵ�ʱ��������Ӧ��Pb��2e����SO42����PbSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�������Խ��Խ���ӵĽ��죬������������������һ�����ơ�ijһ��������������ʱ����������������ɫ���̣��������һ������Ⱦ�����п����ǣ� ��
A.����þ�۳�
B.�������۳�
C.��������۳�
D.�������۳�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������������ٴ��ع��������ٿ����������˿����Ӳģ�ߺ�ѧ�������ڹ�ҵ�ϳ����ø��»�ԭWO3����ȡ�����١��ش�����������
��1�����ٿ�(��Ҫ�ɷ���CaWO4)�����ᷴӦ���ɳ��������ճ������ɵõ�WO3������������Ӧ�Ļ�ѧ����ʽΪ_________________��__________________��
��2��T��ʱ��WO3�����µ��IJ���Ӧ����W��ÿһ����Ӧ���ʱ��ƽ�ⳣ�������� WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) ��H1 K1
WO2.9(s)+0.1H2O(g) ��H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) ��H2 K2
WO2.72(s)+0.18H2O(g) ��H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) ��H3 K3
WO2(s)+0.72H2O(g) ��H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) ��H4 K4
W(s)+2H2O(g) ��H4 K4
����¶�����WO3(s)+3H2(g)![]() W(s)+3H2O(g) ��H=_________��K=__________��
W(s)+3H2O(g) ��H=_________��K=__________��
��3��T1��ʱ����һ������WO3��8.0gH2����2L�ܱ���������������Ӧ�� WO3(s)+3H2(g)![]() W(s)+3H2O(g)����������������ʵ���֮����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
W(s)+3H2O(g)����������������ʵ���֮����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��

��T1��ʱ��H2��ƽ��ת����a=_________%����Ӧƽ�ⳣ��K=__________��
������4minʱ���Ͳ�ά���¶�ΪT2������÷�Ӧ����H_______0������8minʱ��С������������![]() _________1.3��(����>���� <������=��)
_________1.3��(����>���� <������=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܹ�����������ǣ� ��
A.H+��CO32-��NO3-B.Ca2+��SO42-��CO32-
C.NH4+��Cl-��SO42-D.Ag+��Na+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ����ɿɱ�ʾΪxNa2CO3��yNaHCO3��zH2O��ȡm g����Ȼ�����1L��ҺM��ȡ��100mLM�����м���50mL1 mol��L��1���ᣬ����ǡ����ȫ��Ӧ����NaCl,ͬʱ����CO2�����Ϊ672mL����״���£��������ƶ���ȷ������ ��
A. m g����Ȼ���к�0.3molNa2CO3 B. m g����Ȼ���к�0.3molNa+
C. ��ҺM��c��Na+��=0.5 mol��L��1 D. ����Ȼ����x:y:z=2:1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���庬��ԼΪ65mg��L��1���Ӻ�ˮ����ȡ��Ĺ�ҵ�������£�
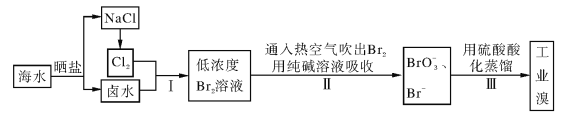
��1�����ϲ�������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ����____��
��2�������ͨ���ȿ�����ˮ��������Br2�����������________��
A�������� B����ԭ�� C���ӷ��� D����ʴ��
��3���������̢����漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ��������_____
![]() Br2��
Br2��![]() CO32-===
CO32-===![]() BrO3-��
BrO3-��![]() Br����
Br����![]() CO2��
CO2��
��4�����������д�������������Ҳ�����ö�������ˮ��Һ���գ�������������������д�������������ˮ��Һ��Ӧ�Ļ�ѧ����ʽ��__________��
��5��ʵ���ҷ����廹�������ܼ���ȡ�������п������������ȡ������_____��
A���Ҵ� B�����Ȼ�̼ C���ռ���Һ D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֶ�����Ԫ����ɵ�A��B��C���ֻ�������ӣ�������18�����ӣ����Ƿ���������ԭ�ӵ���Ŀ����Ϊ2��3��4��A��C�����У���ԭ�Ӹ����ȶ�Ϊ1:1��B������ԭ�Ӹ�����Ϊ1:2�������ֶ�����Ԫ����ɵ�˫��D�����к���10�����ӣ�����A��B���Ӿ��ܷ�Ӧ������һ�ֳ�����10���ӷ���E����ش��������⣺
��1��C�Ļ�ѧʽΪ_____��A�Ļ�ԭ��______B�Ļ�ԭ�ԣ���������������С������
��2��д��B��D����Һ�з�Ӧ�����ӷ���ʽ__________��
��3����̬��A��������ij10���ӷ��ӻ�������̣���д���ð��̳ɷֵĵ���ʽ_______���ð��̵�ˮ��Һ��Ũ�ĺ�D���ӵ���Һ�����������·�Ӧ�����ӷ���ʽΪ_________��
��4��д��һ������18���ӵ���ԭ�ӷ��ӵĻ�ѧʽ_______�����е�һ��Ԫ���γɵĵ��ʿɱ���D���ӵ���Һ��ʴ��������Ӧ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ����ܱ������У����������������ٱ仯ʱ��������Ӧ��A��s����2B��g��![]() C��g����D��g���Ѵ�ƽ����ǣ� ��
C��g����D��g���Ѵ�ƽ����ǣ� ��
A. ��������ѹǿB. ��������ܶ�
C. A�����ʵ���Ũ�ȱ��ֲ���D. ���������ʵ������ֲ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com