
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )

A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
【答案】C
【解析】
根据表中电离常数可知:酸性由强至弱的顺序为CH3COOH> H2CO3>HClO>HCO3-,酸越弱,在稀释过程中pH变化幅度越小,据此分析作答。
A. 根据电离平衡常数可知,酸性:HClO<CH3COOH,则变化大的为CH3COOH,即Ⅰ曲线代表CH3COOH、Ⅱ曲线代表HClO,A项错误;
B. 因酸性比较:H2CO3>HClO>HCO3-,则向NaClO溶液中通入少量二氧化碳,不会产生碳酸根离子,其正确的离子方程式为:ClO﹣+CO2+H2O=HClO+HCO3-,B项错误;
C. ![]() 可变形为
可变形为![]() =
=![]() ,因温度相同,故a、c点该式的值相等,C项正确;
,因温度相同,故a、c点该式的值相等,C项正确;
D. CH3COOH的酸性强于HClO,稀释相同倍数时, a点酸CH3COOH的总浓度小于b点酸HClO的总浓度,D项错误;
答案选C。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论不正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论不正确的是( )
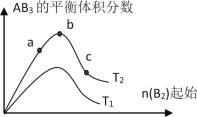
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.达到平衡时,AB3的物质的量大小为:c > b > a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)用氧化物表示翡翠:NaAl(SiO3)2的组成___________________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________________。
(3)在NaHSO4溶液中滴加Ba(OH)2溶液恰好完全沉淀,写出反应的离子方程式____________
(4)写出化学反应方程式
①煅烧黄铁矿__________________________。
②用氨气制硝酸的第一步__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10 mL 2 mol·L-1硫酸溶液,再向其中加
入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
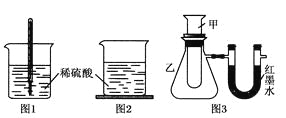
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红
墨水液面高低判断某反应是吸热反应还是放热反应。
序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
① | 氧化钙与水 | 左低右高 |
② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
③ | 铝片与烧碱溶液 | 左低右高 |
④ | 铜与浓硝酸 | 左低右高 |
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写 出该反应的离子方程式:___________。
(2)方案一中,温度升至最大值后又下降的原因是___________。
(3)方案二中,小木片脱落的原因是________,由此得出的结论是__________________。
(4)方案三中,如果甲试管里发生的反应是放热反应,则U形管里红墨水液面:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为________,说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生:![]() ,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
,已知:c(CO2)随温度(T)、时间(t)的变化曲线如图所示,则:
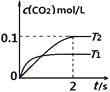
(1)T1____________T2 , 其理由是____________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=____________
(3)下列叙述中能判断该反应达平衡状态的是____________
A. 平衡体系中气体压强不再改变 B. 平衡体系中气体密度不再改变
C. c(CO2):c(N2)=2:1 D. V正(CO):V逆(N2)=2:1
(4)若容器恒容,绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(5)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=_________,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2, 0.5molN2, 则反应向_________(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ_________Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为(请写出两条)_________________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10 mL盐酸于试管中,试回答下列问题:
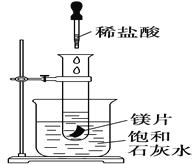
(1)实验中观察到的现象是________________________________ 。
(2)产生上述现象的原因是____________________________。
(3)写出有关反应的离子方程式:_________________________________;
反应中转移了0. 04mol电子时;标准状况下产生多少________mL的H2;消耗镁多少________g(保留两位小数);生成的MgCl2物质的量浓度为________。(溶液体积保持不变)
(4)由实验推知,镁片溶液和盐酸的总能量________(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为________ (填放热反应或者吸热反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的相关化学用语表示正确的是( )
A.质子数为16,中子数为16的硫原子:![]() S
S
B.硫化钠的电子式:![]()
C.二硫化碳分子的比例模型:![]()
D.NaHSO3电离方程式:NaHSO3=Na++H++SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用下列反应制取氯气:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2 H2O
MnCl2 + Cl2↑+ 2 H2O
(1)用双线桥或单线桥的方式表示该反应电子转移的方向和数目:________
(2)该反应中还原剂是________;
(3)标准状况下,收集到2.24 L Cl2时,被氧化的还原剂的物质的量为_____mol,转移电子的物质的量为____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com