
【题目】(12分)A~G各物质间的关系如下图,其中B、D为气态单质。
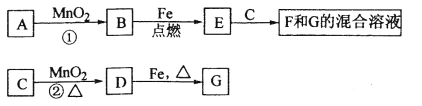
请回答下列问题:
(1)物质C和E的名称分别为 、 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 ;
若只能在加热情况下进行,则反应物A的化学式(分子式)为 ;
(3)反应②的化学方程式为 ;
(4)新配制的F溶液应加入 以防止其转化为G。检验G溶液中阳离子的常用试剂是 (填化学式),实验现象为 。
科目:高中化学 来源: 题型:
【题目】研究碳和硫的化合物的性质,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品。
I. (1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s) +CO2(g)===2Fe3O4(s)+C(s) ΔH=-76.0 kJ·mol-1
①上述反应的还原产物为 ,每生成1 mol Fe3O4,转移电子的物质的量为________mol;
②已知:C(s) +2H2O(g)===CO2(g)+2H2(g) ΔH=+113.4 kJ·mol-1,则反应:
3FeO(s) +H2O(g)===Fe3O4(s)+H2(g)的 ΔH=________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
CH4(g)+2H2O(g)。向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L-1,H2 0.8 mol·L-1,CH4 0.8 mol·L-1,H2O 1.6 mol·L-1。则300℃时上述反应的平衡常数K=________。200℃时该反应的平衡常数K=64.8,则该反应的ΔH________(填“>”或“<”)0。
Ⅱ. SO2直接排放会对环境造成危害。SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③能说明上述反应达到平衡状态的是 。
a. SO2 的消耗速率与CO2 的生成速率相同 b. 混合气体的密度不变
c. S2的浓度不变 d. SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.c(Na+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
d.水电离出c(H+)=1×10-8 mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的电极反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境关系密切,下列说法不正确的是( )
A.铝盐和铁盐都可用作净水剂
B.NH4Cl和ZnCl2溶液可用作焊接时的除锈剂
C.用牺牲镁块的方法防止地下钢铁管道的腐蚀
D.电解熔融氧化镁可以得到镁,电解熔融氯化镁不能得到镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是( )
A.制CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2=2CuO;Cu+H2SO4(稀)=CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
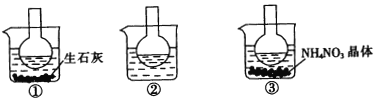
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是___________.
A.水解反应为放热 反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向三份0.01 mol L—1的CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体,则CH3COO-的水解平衡分别________、_________、_________。(填向“左移动”“向右移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与 I-反应生成 I3-,并在溶液中建立如下平衡: I2+I-![]() I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
Ⅰ.某同学为测定上述平衡体系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用________做指示剂,滴定终点的现象是_____________________。
(2)下列对该同学设计方案的分析,正确的是________(填字母)。
A.方案可行。能准确测定溶液中的 c(I2)
B.不可行。因为 I-能与 Na2S2O3发生反应
C.不可行。只能测得溶液中 c(I2)与 c(I3-)之和
Ⅱ.化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知: ①I-和 I3-不溶于 CCl4; ②一定温度下, 碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。试指出该操作中应注意的事项为________。 (任写一条)
(4)上述测定过程均正常操作,下层液体中碘单质的物质的量浓度是________;若终点读数时俯视滴定管, 则会造成所测浓度________ (填“等于”、 “大于”或“小于”)该值。
(5)实验测得上层溶液中 c(I3-)=0.0049 mol·L-1,结合上述有关数据,计算室温条件下反应 I2+I-![]() I3-的平衡常数 K=________(用具体数据列出计算式即可)。
I3-的平衡常数 K=________(用具体数据列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com