
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:

(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由_______________。
(2)25℃时,将pH = 11的NaOH溶液与pH = 4的H2SO4溶液混合,若所得混合溶液的pH = 10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(3)95℃时,若10体积pH1= a的某强酸溶液与1体积pH2= b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________。
(4)曲线B对应温度下,pH = 2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:__________________。
【答案】
(1)A;水的电离是吸热过程,温度低,电离程度小,c(H+)、c(OH-)小
(2)2:9
(3)a+b=13或 pH1 + pH2 = 13
(4)曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH = 5
【解析】
试题分析:
(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,则曲线A为25℃时的电离平衡曲线;
(2)25℃时,pH = 11的NaOH溶液中c(OH-)碱=10-3mol/L,pH = 4的H2SO4溶液中c(H+)酸=10-4mol/L,所得混合溶液的pH = 10,说明酸、碱混合时碱过量溶液呈碱性,混合溶液中c(OH-)混=10-4mol/L,设酸的体积为V(H2SO4),碱的体积为V(NaOH),则有:c(OH-)混×[V(H2SO4)+V(NaOH)]=c(OH-)碱×V(NaOH)-c(H+)酸×V(H2SO4),求解可得:V(NaOH):V(H2SO4)=2:9;
(3)要注意的是95°C时,水的离子积为10-12,即酸、碱浓度相等时pH(酸)+pH(碱)=12,现强碱的OH-浓度是强酸H+浓度的10倍,所以pH(酸)+pH(碱)=13,即pH1+pH2=13,或a+b=13;
(4)曲线B对应95℃,pH=2的某酸HA中氢离子浓度与pH=10的NaOH溶液中氢氧根离子浓度相等,HA若为强酸,完全反应后pH=6,实际上pH=5,说明酸过量,则该酸为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性;故答案为:曲线B对应95℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
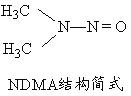
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验现象描述错误的是
A. 碘单质受热升华:紫色蒸气 B. 硫磺在氧气中燃烧:蓝紫色的火焰
C. 铁丝在氯气中燃烧:棕褐色的烟 D. 氢气在氯气中燃烧:淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
① 称取1.5680 g样品,准确配成100 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③ 再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO![]() )≤1.0×10-5 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
)≤1.0×10-5 mol·L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对组成细胞的化学元素的叙述,错误的是
A. 组成细胞的化学元素常见的有20多种
B. 组成不同生物体细胞的化学元素种类是大体相同的
C. 在同种生物体细胞中,不同化学元素的含量相差很大
D. 不同生物体内各种化学元素的比例基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠的反应实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液滴定盐酸时,由于滴定速率太快,当混合溶液变红时,不知NaOH是否过量,判断它是否过量的方法是( )
A.加入5 mL盐酸进行滴定
B.再滴一滴待测盐酸
C.重新进行滴定
D.以上方法均不适用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.在过程③、④、⑤中,溴元素均被氧化
C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com