
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
| [NO2]2 |
| [N2O4] |
| [NO2]2 |
| [N2O4] |
| 2.8mol-1.60mol |
| 2.80mol |
| ||
| 40s-20s |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、从海水提取物质不一定都必须通过化学反应才能实现 |
| B、大量的氮、磷废水排入海洋,易引发赤潮 |
| C、为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
| D、保护加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
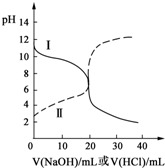 25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1000mol?L-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000mol?L-1NaOH溶液、0.1000mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A、根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3?H2O)≈10-5 |
| B、当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交 |
| C、曲线Ⅱ:滴加溶液到10.00 mL时,溶液中c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
| D、在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁过程中发生的反应:
高炉炼铁过程中发生的反应:| 1 |
| 3 |
| 2 |
| 3 |
| A、1个 | B、2个 | C、3个 | D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和③ | B、只有② |
| C、只有③ | D、①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醇 |
| 醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com