
| 主族 周期 |
IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
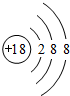 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| t/℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
| 时间(s) N(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
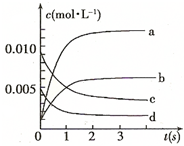 (14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
(14分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N O)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)-c(X-)=9.9×10-7mol/L |
| B、c(Na+)=c(X-)+c(HX)=0.1mol/L |
| C、c(OH-)-c(HX)=c(H+)=1×10-6mol/L |
| D、混合溶液中由水电离出的c(OH-)小于0.2mol/LHX溶液中由水电离出的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、4.5 | C、5.5 | D、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com