
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(OH)3]=4.0×10﹣38) Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为:
(2)过程Ⅰ加入铁屑的主要作用是 , 分离得到固体的主要成分是 , 从固体中分离出铜需采用的方法是;
(3)过程Ⅱ中发生反应的化学方程式为;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 . (列式计算)
【答案】
(1)2Fe3++Cu=2Fe2++Cu2+
(2)回收铜;Cu和Fe;加入盐酸反应后过滤
(3)FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)c(Fe3+)= ![]() =4×10﹣11mol/L
=4×10﹣11mol/L
【解析】解:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+ , 所以答案是:2Fe3++Cu=2Fe2++Cu2+;(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜, 所以答案是:回收铜;Cu和Fe;加入盐酸反应后过滤;(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3 , 所以答案是:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10﹣9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)Fe3++3OH﹣;Ksp=c(Fe3+)×c3(OH﹣);c(Fe3+)= ![]() =4×10﹣11mol/L;所以答案是:c(Fe3+)=
=4×10﹣11mol/L;所以答案是:c(Fe3+)= ![]() =4×10﹣11mol/L.
=4×10﹣11mol/L.


科目:高中化学 来源: 题型:
【题目】下面有关丙烷、丙烯、丙炔说法中正确的有( )
A.丙烷、丙烯、丙炔的结构式分别为 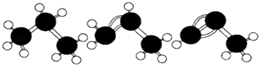
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相对条件下密度逐渐增大
D.丙烷的碳原子空间结构是锯齿型的,不是简单的线性排列
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示. 
回答下列问题:
(1)图B对应的物质名称是 , 其晶胞中的原子数为 , 晶体类型为 .
(2)d中元素的原子核外电子排布式为 .
(3)图A中由二种元素组成的物质中,沸点最高的是 , 原因是 , 该物质的分子构型为 , 中心原子的杂化轨道类型为 .
(4)图A中的双原子分子中,极性最大的分子是 .
(5)k的分子式为 , 中心原子的杂化轨道类型为 , 属于分子(填“极性”或“非极性”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸.满足上述条件的混合物是( )
A.BaCl2和(NH4)2S03
B.AgNO3和NH4Cl
C.FeCl3和NaHCO3
D.KCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率
B.以同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )
A. 分散系的分类
分散系的分类
B. 稀释浓氢氧化钠溶液的过程
稀释浓氢氧化钠溶液的过程
C. 向碳酸钠溶液中逐滴滴加盐酸
向碳酸钠溶液中逐滴滴加盐酸
D. 向偏铝酸钠溶液中逐滴滴加盐酸
向偏铝酸钠溶液中逐滴滴加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三瓶等体积、等物质的量浓度的硫酸,若将甲用水稀释,在乙中加入少量BaCl2溶液,丙不变,然后分别与等浓度的NaOH溶液混合,至完全反应时,所消耗的NaOH溶液的体积是
A. 丙>乙>甲 B. 甲=丙>乙 C. 甲=丙=乙 D. 乙>丙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com