
【题目】下列由电子排布式所得的结论错误的是![]()
选项 | 电子排布式 | 结论 |
A |
| 违背洪特规则 |
B |
| 违背能量最低原理 |
C |
| 违背泡利原理 |
D |
| 违背能量最低原理 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol·L-1稀盐酸、0.500 mol·L-1 的NaOH溶液来制备一水硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制取
①实验室用铜与浓硫酸制备硫酸铜溶液时,往往会产生有污染的SO2气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
②实际生产中往往将铜片在空气中加热,使其氧化生成CuO,再溶解在稀硫酸中即可得到硫酸铜溶液;这一过程缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
③所以工业上进行了改进,可以在浸入硫酸中的铜片表面不断通 O2,并加热;也可以在硫酸和铜的混合容器中滴加 H2O2 溶液。
④趁热过滤得蓝色溶液。
(1)某同学在上述实验制备硫酸铜溶液时铜有剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因________________。
(2)若按③进行制备,请写出Cu在H2O2 作用下和稀硫酸反应的化学方程式_______________。
(3)H2O2溶液的浓度对铜片的溶解速率有影响。现通过下图将少量30%的H2O2溶液浓缩至40%,在B处应增加一个设备,该设备的作用是____________馏出物是 ______________________。


II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
(1)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为 Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(2)继续滴加 NH3·H2O,会转化生成深蓝色溶液,请写出从深蓝色溶液中析出深蓝色晶体的方法____________。并说明理由____________。
Ⅲ.产品纯度的测定
精确称取 mg 晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量 NaOH 溶液, 通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 V1mL 0.500mol·L-1 的盐酸标准溶液完全吸收。取下接收瓶,用 0.500 mol·L-1 NaOH 标准溶液滴定过剩的 HCl(选用 甲基橙作指示剂),到终点时消耗 V2mLNaOH 溶液。

1.水 2.长玻璃管 3.10%NaOH溶液 4.样品液 5.盐酸标准溶液
(1)玻璃管2的作用________________。
(2)样品中产品纯度的表达式________________。(不用化简)
(3)下列实验操作可能使氨含量测定结果偏低的原因是_________________
A.滴定时未用 NaOH 标准溶液润洗滴定管
B.滴定过程中选用酚酞作指示剂
C.读数时,滴定前平视,滴定后俯视
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
E.由于操作不规范,滴定前无气泡,滴定后滴定管中产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸盐(如ZnS2O4)在工业中用作漂白剂、解毒剂、吸氧剂等,用途十分广泛。
Ⅰ.制取ZnS2O4溶液和晶体
控制3545℃进行反应,原理为:Zn+2SO2=ZnS2O4。
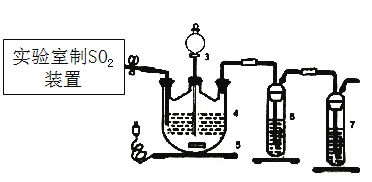
(1)下列四种制备SO2的方案中最佳选择是___________。
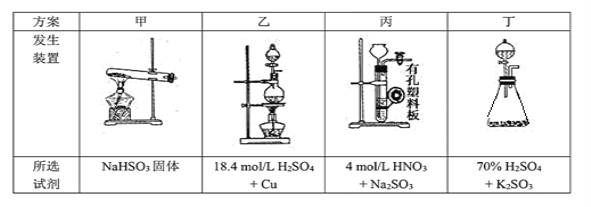
(2)停止电加热,仪器3放入一定量乙醇,制得ZnS2O4晶体,主要原因是_________。
Ⅱ.测定产率
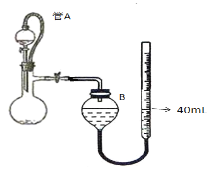
(3)仪器4中加入mg锌粉与一定量的水,电加热并启动磁力搅拌器5。一段时间后,待固体物质完全消失时,关闭活塞和止水夹。取ZnS2O4晶体的十分之一放于真空容器中,加适量的水、通适量氧气使其恰好转化为Zn(HSO4)2和Zn(HSO3)2固体,然后加入足量的硫酸,通过测定生成气体的体积来求算ZnS2O4晶体的产率。请回答下列相关问题:
①测定装置中,导管A的作用:一是________;二是________。
②为提高测定的准确度,仪器B中最宜选用_____________。
A.饱和食盐水 B.饱和NaHSO3溶液 C. 饱和澄清石灰水 D.98.3%的浓硫酸
③用图中量气管读数为起点,若终点读数为17.60mL,且实验温度下气体摩尔体积为VmL.mol-1,可得出ZnS2O4的产率为 ____________%。
(4)如果反应温度超过45℃,会导致ZnS2O4分解,仪器4中有黄色沉淀、白色沉淀且伴随着气泡生成,则ZnS2O4分解的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列反应的平衡常数的数值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030;
N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081;
2H2O(g) K2=2×1081;
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92。
2CO(g)+O2(g) K3=4×10-92。
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-82
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.ns能级上单个电子的能量不一定高于![]() 能级上单个电子的能量
能级上单个电子的能量
B.基态C原子的电子排布式![]() 违反了洪特规则
违反了洪特规则
C.基态Sc原子的电子排布式![]() 违反了能量最低原理
违反了能量最低原理
D.基态Ti原子的电子排布式![]() 违反了泡利原理
违反了泡利原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿样用过量酸溶解并过滤,所得滤液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
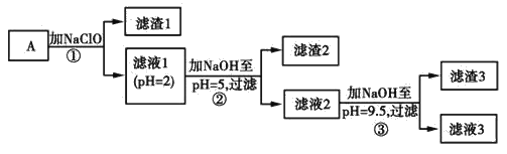
可能用到的有关数据如下:
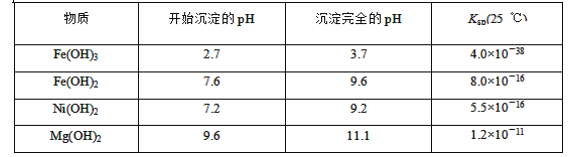
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,装置正确且能达到实验目的的是( )
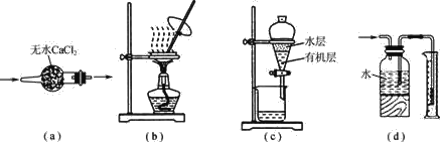
A.用图a所示装置干燥SO2气体
B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体
C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出
D.用图d所示装置测量氨气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:

(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,还含有Fe2+、Cu2+等杂质。先加入____(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__molKMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的物质是_____。
(4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450℃~500℃下进行,“煅烧”反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
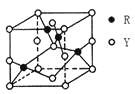
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com