
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。用惰性电极电解时,下列说法正确的是:

A.a极产生氧气,b极产生氢气
B.a电极区溶液pH值减小
C.含铬微粒主要以Cr2O72-形式在b极区聚集
D.CrO42-能从浆液中分离出来向a极区迁移
科目:高中化学 来源: 题型:
【题目】半导体有单质、二元化合物、三元化合物等之分,其中三元半导体CuAlO2(或Cu2Al2O4)的制取,常采用CuO与Al2O3或Al(OH)3共热的方法。试分析并回答:
(l)试完成如下化学方程式:
_______CuO+_______ Al2O3![]() _______Cu2Al2O4+_______ ↑
_______Cu2Al2O4+_______ ↑
(2)上述反应能发生的理由主要是_____________。
(3)Al(OH)3有碱式和酸式两种电离方式,若25℃时,其酸式电离为Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-
AlO2-+H++H2O K=2.0×10-13,则入Al(OH)3+OH-![]() AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
AlO2-+2H2O的平衡常数K’=_______(列式并计算)。该反应的△H_______(填“<”“>”或“=”)0。
(4)经实验测定,“AlO2-” 的形式应该是[Al(OH)4]-,则AlCl3溶液与Na[Al(OH)4]溶液作用的离子方程式是_________________。
(5)用石墨电极电解Na[Al(OH)4] 溶液是制取高品质用Al(OH)3的方法之一。该电解反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
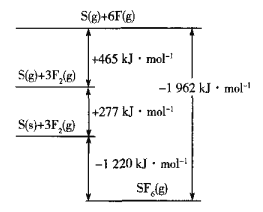
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
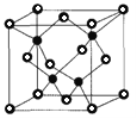
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为:![]()
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
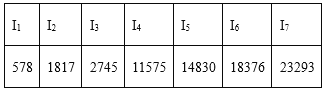
D. 某主族元素的电离能I1~I7数据如上表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅢA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热的容器中进行反应:2A(g)+B(g)![]() 3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
A.容器中压强不变,表明反应达到平衡状态
B.反应过程中A、B的转化率始终相同
C.增加A的浓度,平衡时B的体积分数减少
D.容器中气体的密度不变,表明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
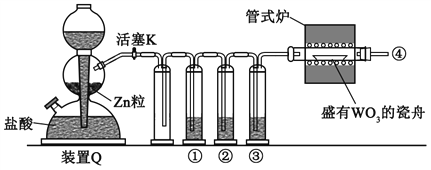
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素Q、W、X、Y、Z,位于不同主族,原子序数依次增大。
①W的氢化物与最高价氧化物对应水化物反应生成盐甲
②X、Y、Z的最高价氧化物对应水化物之间两两反应生成均可生成盐和水
③化合物X2O2可与Q的某种气态氧化物(标准状况下密度为1.25gL-1)在一定条件下发生化合反应,生成一种正盐乙
请回答下列各题:
(1)已知:ZO3n-+M2++H+→Z―+M4++H2O(M为金属元素,方程式未配平),则Z原子的结构示意图为___,n=___
(2)过程③的化学方程式为___。
(3)甲的水溶液呈___性(填“酸”、“碱”或“中”),原因是___(用离子方程式表示)。
(4)将Y单质粉末加入到盐乙的浓溶液中,缓慢放出气泡,加热后有大量气泡生成,同时生成白色沉淀丙。经检验气体是由单质A和少量Q的最高价氧化物组成。下列有关说法正确的是___。
A.Q元素是形成化合物种类最多的元素
B.单质A是热值最高的物质
C.白色沉淀丙既可溶于稀盐酸,也能溶于NaOH
D.白色沉淀丙可能是由生成的YO2-离子与溶液中存在的某种离子反应生成
(5)Y可形成三元半导体CuYO2,此三元半导体难溶于水,可溶于稀硝酸,且有NO生成,写出溶解过程的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO能与Na反应放出氢气的共有![]() 不考虑立体异构
不考虑立体异构![]() ( )
( )
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:
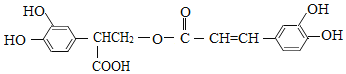
以邻苯二酚为原料合成迷迭香酸的路线为:
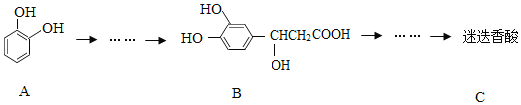
下列说法错误的是( )
A. 有机物B可以发生取代、加成、消去、氧化反应
B. 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH
C. 迷迭香酸在稀硫酸催化下水解的一种产物可由B转化得到
D. 有机物A分子中所有原子可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com