
【题目】在恒容绝热的容器中进行反应:2A(g)+B(g)![]() 3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
A.容器中压强不变,表明反应达到平衡状态
B.反应过程中A、B的转化率始终相同
C.增加A的浓度,平衡时B的体积分数减少
D.容器中气体的密度不变,表明反应达到平衡状态
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
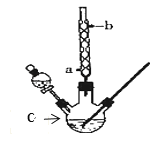
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学使我们的生活更加美好。使用自热材料的暖贴、自热食品极大的方便了人们的生活。
(1)自热材料是利用化学反应原理,将_____能转化为热能供人们使用。一般利用原电池原理来_____(“加快”或“减慢”)放热速度。
(2)暖贴中自热材料的主要化学成分有:铁粉、炭粉、氯化钠固体、其他辅助成分及保温材料等,并用可控制氧气透过速率的无纺布包装。在工作时,铁粉与炭粉形成原电池反应,该反应过程中的能量变化关系图中,正确的是______。

(3)控制适当的氧气透过速率,使暖贴保持一个适合人体的温度,无纺布非常重要。制作无纺布的原料为丙烯,丙烯结构如图。关于丙烯分子内的相互作用有______。
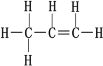
A.共价键 B.离子键 C.范德华力 D.氢键
(4)自热食品的自热材料中,除有暖贴当中的成分外,还有生石灰、铝粉、碳酸钠等,仍用无纺布包装。使用时先加适量的水。开始时有放热的非氧化还原反应发生,其化学方程式为_____。然后会形成强碱性溶液,并进一步发生剧烈反应,并产生一种易燃易爆的气体,大量放热,将食品煮熟。该反应的离子方程式为:_______。商家为保证迅速放热,采取了以下哪些加速反应的措施:_____。
①形成原电池反应 ②将铝粒制成铝粉 ③增大压强 ④使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。用惰性电极电解时,下列说法正确的是:

A.a极产生氧气,b极产生氢气
B.a电极区溶液pH值减小
C.含铬微粒主要以Cr2O72-形式在b极区聚集
D.CrO42-能从浆液中分离出来向a极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人民网报道:在巴勒斯坦已故领导人阿拉法特的遗物中检出超过正常标准的高放射性元素![]() Po。下列有关叙述正确的是( )
Po。下列有关叙述正确的是( )
A.Po的相对原子质量为210
B.![]() Po与
Po与![]() Po互为同素异形体
Po互为同素异形体
C.Po位于第六周期ⅥA族
D.![]() Po原子核内的中子数为84
Po原子核内的中子数为84
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
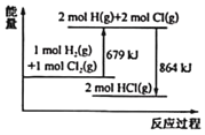
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO.下列叙述正确的是( )
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为﹣3
D.氮化铝晶体属于分子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com