
【题目】化学使我们的生活更加美好。使用自热材料的暖贴、自热食品极大的方便了人们的生活。
(1)自热材料是利用化学反应原理,将_____能转化为热能供人们使用。一般利用原电池原理来_____(“加快”或“减慢”)放热速度。
(2)暖贴中自热材料的主要化学成分有:铁粉、炭粉、氯化钠固体、其他辅助成分及保温材料等,并用可控制氧气透过速率的无纺布包装。在工作时,铁粉与炭粉形成原电池反应,该反应过程中的能量变化关系图中,正确的是______。

(3)控制适当的氧气透过速率,使暖贴保持一个适合人体的温度,无纺布非常重要。制作无纺布的原料为丙烯,丙烯结构如图。关于丙烯分子内的相互作用有______。
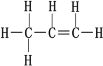
A.共价键 B.离子键 C.范德华力 D.氢键
(4)自热食品的自热材料中,除有暖贴当中的成分外,还有生石灰、铝粉、碳酸钠等,仍用无纺布包装。使用时先加适量的水。开始时有放热的非氧化还原反应发生,其化学方程式为_____。然后会形成强碱性溶液,并进一步发生剧烈反应,并产生一种易燃易爆的气体,大量放热,将食品煮熟。该反应的离子方程式为:_______。商家为保证迅速放热,采取了以下哪些加速反应的措施:_____。
①形成原电池反应 ②将铝粒制成铝粉 ③增大压强 ④使用催化剂
【答案】化学 加快 B A CaO+H2O=Ca(OH)2 2Al+2OH-+2H2O=2AlO2-+3H2↑ ①②
【解析】
(1)自热材料通过化学反应,将化学能转化为热能;构成原电池加快反应速率,所以一般利用原电池原理来加快反应速度;
(2)暖贴中铁粉、炭粉、氯化钠固体及其他辅助成分的反应是放热反应,反应物的总能量大于生成物的总能量,故选B;
(3)丙烯分子是共价分子,分之内只含C-H、C-C、C=C共价键,故选A;
(4)自热食品的自热材料中,生石灰和水反应生成氢氧化钙是放热的非氧化还原反应,反应方程式是CaO+H2O=Ca(OH)2;
铝和强碱反应放出氢气,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;
①自热材料中铝、碳构成原电池,能加快反应速率,故选①;②将铝粒制成铝粉,增大了接触面积,加快反应速率,故选②;③用无纺布包装,没有增大压强,故不选③;④根据加入材料分析,没有使用催化剂,故不选④;选①②。


科目:高中化学 来源: 题型:
【题目】O2辅助的Al—CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。该电池多孔碳电极的反应式为: 6O2 + 6e = 6O2 6CO2+6O2 = 3C2O42+6O2。该装置工作时下列说法不正确的是
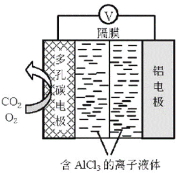
A.多孔碳电极有利于气体扩散至电极表面
B.铝电极为上的电势比多孔碳电极上的高
C.反应过程中O2的作用是催化剂
D.该电池的总反应式为:2Al+6CO2=Al(C2O4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
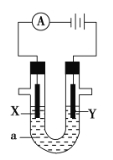
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体必需的微量元素,在元素周期表中的位置如图所示。下列关于硒元素的叙述正确的是

A.硒元素位于元素周期表第四周期第IVA族
B.H2Se比HBr稳定
C.硒的非金属性比S弱
D.硒最高价氧化物对应水化物的化学式为H2SeO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构如图。有关核黄素的下列说法中,不正确的是( )
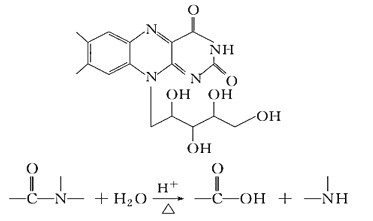
A. 该有机物的分子式为C17H21N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 该化合物能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
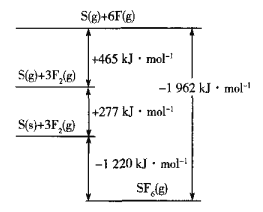
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
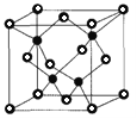
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
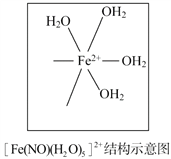
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热的容器中进行反应:2A(g)+B(g)![]() 3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
3C(g)+D(s)△H=-akJ·mol-1(a>0),下列说法不正确的是
A.容器中压强不变,表明反应达到平衡状态
B.反应过程中A、B的转化率始终相同
C.增加A的浓度,平衡时B的体积分数减少
D.容器中气体的密度不变,表明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式和离子方程式书写不正确的是( )
A. 甲苯和液溴可以发生如下的反应:![]() +Br2
+Br2![]()
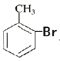 +HBr
+HBr
B. 甲酸溶液与足量的银氨溶液共热的化学方程式:HCOOH +2Ag(NH3)2OH![]() (NH4)2CO3+H2O+ 2Ag↓ +3NH3
(NH4)2CO3+H2O+ 2Ag↓ +3NH3
C. 苯酚钠溶液中通入少量二氧化碳反应的离子方程式:![]()
D. 尼泊金酸(![]() )与碳酸氢钠溶液反应的离子方程式
)与碳酸氢钠溶液反应的离子方程式![]() +HCO3-→
+HCO3-→![]() +H2O+CO2↑
+H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com